慢病毒的结构
慢病毒虽然属于逆转录病毒科的一种,但其结构和基因组的复杂程度远超其他逆转录病毒。这也使得慢病毒具有独特的整合机制和病毒感染持久性。
慢病毒整体大小约100nm,在病毒载体中属于体积较大类型。其包装容量一般在4.5-5kb左右,能够满足一般的细胞治疗需求。
目前细胞治疗中所使用的慢病毒载体来源于HIV-1,其原型包含九个关键病毒基因,分别是:gag、pol、env、tat、rev、vif、vpr、vpu、nef。其中gag基因可以编码病毒所需的核心蛋白;pol基因编码病毒复制所需要的酶;env基因编码病毒的包膜糖蛋白。这三个基因编码结构蛋白和蛋白酶,是保证病毒复制能力的关键基因,并且可以决定病毒感染宿主的靶向性。在病毒表达的过程中还需要一些顺式作用元件,包括长末端重复序列(LTRs)、TAT 激活区(TAR)、剪接供体和受体位点、包装和二聚化信号(Ψ)、Rev 反应元件(RRE)以及中央和末端多聚嘌呤区(PPT)等[1]。理论上,我们需要在两端的LTRs中间插入我们需要慢病毒表达的目的基因,送入靶细胞之中并表达来实现外源基因的表达。
从结构上看,慢病毒与 Mulv 逆转录病毒载体相比,更倾向于整合到宿主基因组远离转录起始点的位点的非活性转录区域中,其激活原癌基因沉默的风险低于 Mulv 逆转录病毒载体。
慢病毒作为细胞治疗的载体的优势:
- 更有效、更广泛地感染分裂及非分裂的细胞、组织;
- 更大的包装容量;
- 更低的细胞毒性和免疫原性;
- 更好的表达效果。
但是与此同时,由于慢病毒存在复制能力,在作为细胞治疗的载体过程中需要最大程度地降低其成瘤性和致瘤性,对慢病毒载体的安全性进行优化。
第一代
基于 HIV-1 的慢病毒载体将载体组分成三个质粒以增加安全性:
1. 包装质粒:包装载体含有除包膜蛋白编码基因的全病毒基因组,使用CMV启动子进行表达,并用人胰岛素基因的polyA替代3’LTR作为加尾信号,包装质粒上的包装信号或 LTRs 删除,来减少载体制剂中复制型感染性慢病毒(RCLs)的产生;
2. 编码病毒糖蛋白的 Env 质粒(包膜质粒):包膜蛋白单独置于一个质粒中进行表达;
3. 转移质粒(载体质粒):外源插入片段以及所有相关顺式作用元件置于外源表达载体中[2]。
第二代
包装系统删掉了包装质粒中HIV的所有附属基因vif、vpu、vpr和nef,以减少产生RCL的风险。这些附属基因的去除并不影响病毒的滴度和转染能力,同时增加了载体的安全性[3]。
第三代
包装系统进一步升级,由四个质粒组成。此系统将原来的一个包装质粒分成两个质粒:一个编码 rev基因 ,另一个编码 gag 和 pol基因,包装质粒与任何表达慢病毒载体没有显著同源性,最大程度减少三个基因同时整合的可能性。通过将转移质粒 5'LTR 的 U3 启动子区替换为来自 CMV 或 RSV 的强病毒启动子构建 tat 非依赖性的质粒,用异源启动子序列取代tat基因后,原型HIV基因组中的9个基因在慢病毒载体中只保留了3个(gag、pol和rev)[4]。删除了U3区的3'LTR的慢病毒颗粒在转导、整合到靶细胞的基因组 DNA 中后自我失活,通过构建自身失活的慢病毒载体,使载体失去HIV-1增强子及启动子序列,即使存在所有的病毒蛋白也不能转录出RNA;第三代系统有效地减少了 RCLs 的产生并提高了生物安全性。
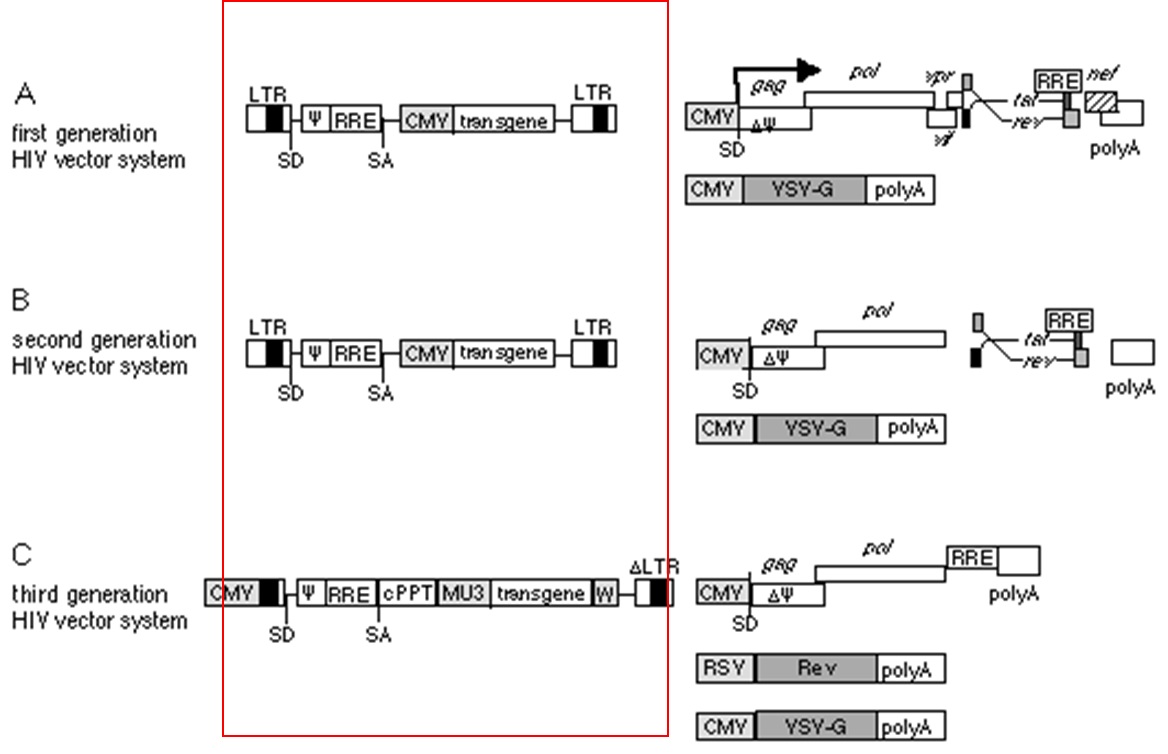
图1:第一(A)、二(B)、三(C)代包装系统
有研究表明,在某些情况下四质粒系统出毒略低,成本更高。安必奇生物从工艺到质控,全方位提升准确性和安全性,提供定制病毒包装服务。
【参考文献】
1. Trono, D. Lentiviral Vectors (Berlin-Heidelberg, Springer-Verlag, 2002).
2. Sakuma, T., Barry, M. A. and Ikeda, Y. (2012) Lentiviral vectors: basic to translational. J. Biochem. 443, 603–618.
3. Zufferey R, Nagy D, Mandel R J, et al.(1997). Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo. Nature Biotechnology. 15,871-875.
4. Dull T, Zufferey R, Kelly M, et al. (1998). A third-generation lentivirus vector with a conditional packaging system. Journal of Virology. 72, 8463-8471.
