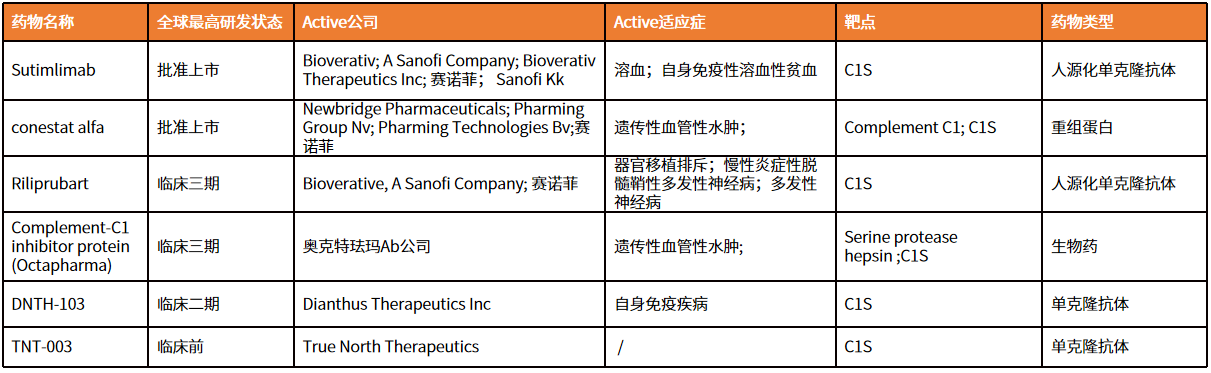
2024年10月,赛诺菲将补体C1S抗体药物Enjzymo的全球权益出售给意大利老牌药企Recordati。该药物主要用于治疗自身免疫性溶血性贫血,后者支付8.25亿美元预付款,2.5亿美元商业里程碑金额。据统计,截至2024年8月,Enjzymo收入超1.1亿美元,预计2025财年收入将超过1.65亿美元。随着对补体药物研究的不断深入,在研补体药物数量持续增长,适应症也拓展到神经学、眼科、肌无力和糖尿病肾病等,补体药物也进入了2.0新时代。
补体系统和C1S在维持体内平衡方面起着关键作用,他们的功能障碍与多种罕见病及自身免疫性疾病相关。激活的C1S会作用于许多细胞蛋白并发挥多种调节作用,已发现激活的C1S从细胞表面切割主要组织相容性复合体I (MHC I)并水解β2-微球蛋白(β2-microglobulin,B2M),影响T细胞介导的免疫反应。C1S还可以切割高迁移率族蛋白B1(HMGB1),这是自身免疫性疾病中的一种显著的自身抗原。因此,C1S激活会通过多种机制影响生理和病理过程。另外,C1S的抑制可以在补体级联反应的早期阶段阻断该系统。因此,通过抑制C1S来抑制过度活化的补体通路成为了新的选择。
近岸蛋白提供高质量C3/C5/C8/C1S/C1q R1等系列补体蛋白产品,适用于动物免疫、抗体筛选、功能评估和质量控制等不同环节的需求。
C1S靶点简介
补体是一组多分子能自身装配的生物活性系统,由近20种理化性状和免疫学特性不同的血浆蛋白组成,被激活时,前体各成分分子便按一定顺序呈链锁的酶促反应。有两种活化途径:“经典途径”(抗原抗体结合而启动)及“替代途径”(被微生物等激活)。激活所产生的小肽可致炎症反应及调节免疫等。
经典途径由C1触发,C1是一种由识别蛋白C1q和两种丝氨酸蛋白酶C1r和C1S组成的多分子复合物。在C1q识别之后,C1r被自动激活,并进而激活C1S。C1r和C1S的激活都涉及切割特定的Arg-Ile键,将单链原酶转化为二硫键连接的活性蛋白酶(A和B)。活化的C1S随后裂解底物C4和C2,导致C3转化酶(C4b和C2b的复合物)的形成,C3转化酶将C3裂解为C3a和C3b,然后裂解C5并触发由C5b、C6、C7、C8和聚合物C9组成的所谓膜攻击复合物(MAC)的形成[1-4]。
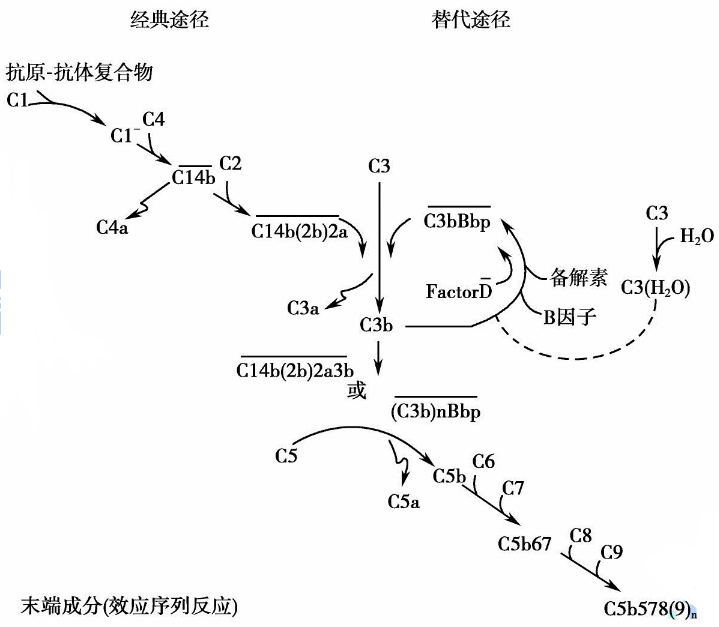
图1. C1S经典途径和替代途径
C1S基因位于12号染色体的短臂(12p13.31),包含12个外显子,编码688个氨基酸的前体C1S蛋白[5,6]。在其N末端区域,该蛋白含有通过表皮生长因子(EGF)样结构域连接的CUB2和CUB1结构域,随后是补体控制蛋白(CCP)模块CCP1和CCP2。C1S的C末端区域具有丝氨酸蛋白酶(SP)结构域(残基423-688),其包含活化肽样片段(残基424-437)。在其活化过程中,C1S被切割成422个氨基酸的重链(A链)和251个氨基酸的轻链(B链)。值得注意的是,C1S在许多位点被糖基化,其丝氨酸蛋白酶活性显示出胰蛋白酶样特异性,并切割底物蛋白中的精氨酸键。
靶向C1S药物的进展
补体系统和C1S在维持体内平衡中的关键作用使它们的功能障碍与多种疾病相关。C1S的异常激活影响自身免疫性和感染性疾病和癌症的发展,并作为信息生物标志物和治疗靶点。目前,已经开发了许多靶向C1S的小分子、肽和单克隆抗体。其中一些抗体正在临床试验中进行评估,而由赛诺菲(Sanofi)的全资子公司Bioverativ研发的抗C1S抗体sutimlimab于2022年02月04日首次在美国上市,并于2022-11-15在欧盟EMA获批上市。sutimlimab是first-in-class单克隆抗体,通过靶向抑制C1S阻止CAD中的C1激活溶血的发生。sutimlimab是第一个治疗CAD溶血的药物,并且FDA已授予sutimlimab突破性药物资格和孤儿药资格。
表1.靶向C1S药物的进展
产品推荐
Recombinant Human C1S (Cat.No.:C42Y)
近岸蛋白现推出高质量重组Human C1S由人源细胞表达,蛋白经C1R切割形成A链和B链,生物活性经过BLI亲和力验证,适用于动物免疫、抗体筛选、功能评估和质量控制等不同环节的需求,加速您的抗体药物开发进程。
实验数据展示
生物活性经过BLI亲和力验证
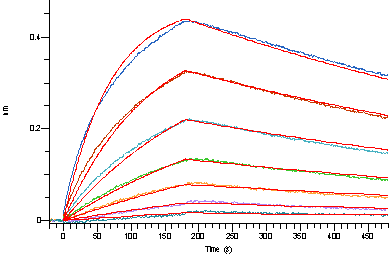
Loaded Recombinant Human Complement C1S (C-6His) (Cat#C42Y) on Pro-A Biosensor, can bind Recombinant anti-C1S antibody (Sutimlimab) with an affinity constant of 8.73 nM as determined in BLI assay.
补体相关产品
|
Target Protein |
Product Name |
Cat.No. |
|
C3 |
Recombinant Human C3a |
CP21 |
|
Recombinant Mouse C3a |
CM99 |
|
|
C5 |
Recombinant Human C5a |
CR52 |
|
Recombinant Mouse C5 |
C075 |
|
|
C8 |
Recombinant Human C8 gamma (N-6His) |
CH44 |
|
C1q R1 |
Recombinant Human C1q R1/CD93 (C-6His) |
C405 |
|
Recombinant Mouse C1q R1/CD93 (C-6His) |
C36B |
|
|
Recombinant Cynomolgus C1q R1/CD93 (C-6His) |
C35Y |
|
|
C1QBP |
Recombinant Human HABP1/ C1QBP (C-6His) |
CF70 |
|
Complement Factor B |
Recombinant Human CFB (C-6His) |
C329 |
|
Complement Factor D |
Recombinant Human CFD (C-10His) |
CP27 |
|
Recombinant Mouse CFD (C-6His) |
CP03 |
|
|
Complement Factor H |
Recombinant Human CFH (C-6His) |
CI77 |
|
Recombinant Mouse CFH (C-6His) |
CB05 |
|
|
Complement Factor H Related Protein |
Recombinant Human CFHR1 (C-6His) |
C585 |
|
Recombinant Human CFHR2 (C-6His) |
C517 |
|
|
Recombinant Human CFHR3 (C-6His) |
CC31 |
|
|
Recombinant Human CFHR4 (C-6His) |
CC30 |
|
|
Recombinant Human CFHR5 (C-6His) |
CC74 |
|
|
Complement Factor MASP3 |
Recombinant Human Complement Factor MASP3 (C-6His) |
C655 |
参考文献
[1]Jager U, D'Sa S, Schorgenhofer C, Bartko J, Derhaschnig U, Sillaber C, et al. Inhibition of complement C1S improves severe hemolytic anemia in cold agglutinin disease: a first-in-human trial. Blood (2019) 133:893–901. doi: 10.1182/blood-2018-06-856930
[2]Roth A, Barcellini W, D'Sa S, Miyakawa Y, Broome CM, Michel M, et al. Sutimlimab in cold agglutinin disease. N Engl J Med (2021) 384:1323–34. doi: 10.1056/NEJMoa2027760
[3]Nikitin PA, Rose EL, Byun TS, Parry GC, Panicker S. C1S inhibition by BIVV009 (Sutimlimab) prevents complement-enhanced activation of autoimmune human b cells In vitro. J Immunol (2019) 202:1200–9. doi: 10.4049/ jimmunol.1800998
[4]Peerschke EI, Panicker S, Bussel J. Classical complement pathway activation in immune thrombocytopenia purpura: inhibition by a novel C1S inhibitor. Br J Haematol (2016) 173:942–5. doi: 10.1111/bjh.13648
[5]Tosi M, Duponchel C, Meo T, Julier C. Complete cDNA sequence of human complement cls and close physical linkage of the homologous genes cls and clr. Biochemistry-US (1987) 26:8516–24. doi: 10.1021/bi00400a004
[6]Nguyen VC, Tosi M, Gross MS, Cohen-Haguenauer O, Jegou-Foubert C, de Tand MF, et al. Assignment of the complement serine protease genes C1r and C1S to chromosome 12 region 12p13. Hum Genet (1988) 78:363–8. doi: 10.1007/BF00291737
