RAW264.7细胞,也被称为小鼠单核巨噬细胞白血病细胞,常被用作研究巨噬细胞功能和生物学特性的模型,细胞可表现出与原发性巨噬细胞相似的功能。因此,RAW264.7细胞在多个研究领域中都有广泛的应用:
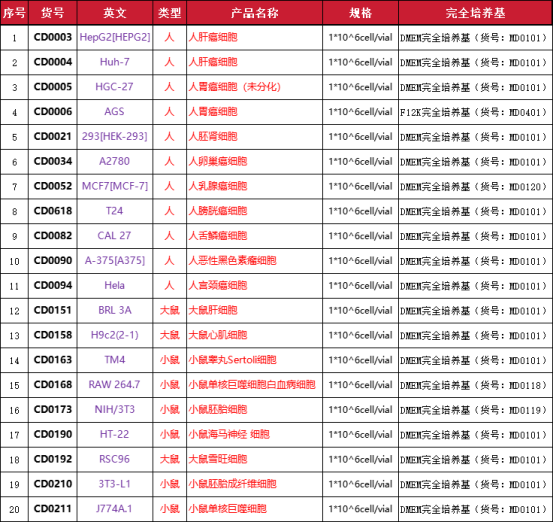
Raw264.7细胞20X展示图(启达生物:CD0168)
1. **骨骼疾病研究**:RAW264.7细胞在体外可以对刺激产生反应,并随后产生具有破骨细胞完全分化的特征的多核细胞。因此,它被广泛用于研究骨骼疾病,如风湿性关节炎、骨质疏松症、骨质溶解、牙周炎等。RAW264.7已被证明在RANKL诱导下容易分化为破骨细胞,使其成为破骨细胞生成研究的常用体外模型。
2. **炎症研究**:RAW264.7细胞也是筛选抗炎活性物和研究炎症最常用的体外研究模型。在诱导剂(如脂多糖LPS)的作用下,RAW264.7细胞会模拟炎症反应,释放或上调多种炎症介质,如一氧化氮(NO)、环氧合酶-2(COX-2)、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等。这使得RAW264.7细胞成为研究炎症过程和开发抗炎药物的宝贵工具。
3. **免疫学研究**:RAW264.7细胞还可以用于研究各种刺激物(如细菌、病毒、寄生虫、细胞因子等)对巨噬细胞的影响,以及巨噬细胞在免疫反应中的作用。
4. **药物筛选和毒理学研究**:RAW264.7细胞也被广泛用于药物筛选和毒理学研究,以评估药物对巨噬细胞功能和生存能力的影响。
Raw264.7如何诱导成破骨细胞呢?

重点来了, 不要瞌睡哦
破骨细胞诱导和检测步骤
1. RAW264.7 细胞培养与接种的密度和梯度稀密会导致RAW264.7细胞生长迅速且容易分化,而状态较好的RAW264.7细胞是诱导破骨细胞的关键。
,细胞复苏后直到密度到90%以上并且换液后第二天发现培养基泛黄,立即终止细胞培养并开始传代,使用瓶内发黄的培养基先轻轻吹打细胞,之后再用PBS吹打一次即可完全收集细胞,若瓶内还贴有不是椭圆形的细胞,一般弃之不用,因为这些raw264.7已经分化,不适合破骨诱导了。
2. RAW 264.7细胞生长较快,且诱导需要4天,诱导前密度梯度培养4天,将RAW264.7细胞按(0.25、0.50、0.75、1.00、1.25、1.50)x10 ^4/cm²”的密度接种到24孔板中,培养4天后用1%的甲苯胺蓝染色观察细胞生长状态,找出RAW264.7细胞的最佳诱导密度。
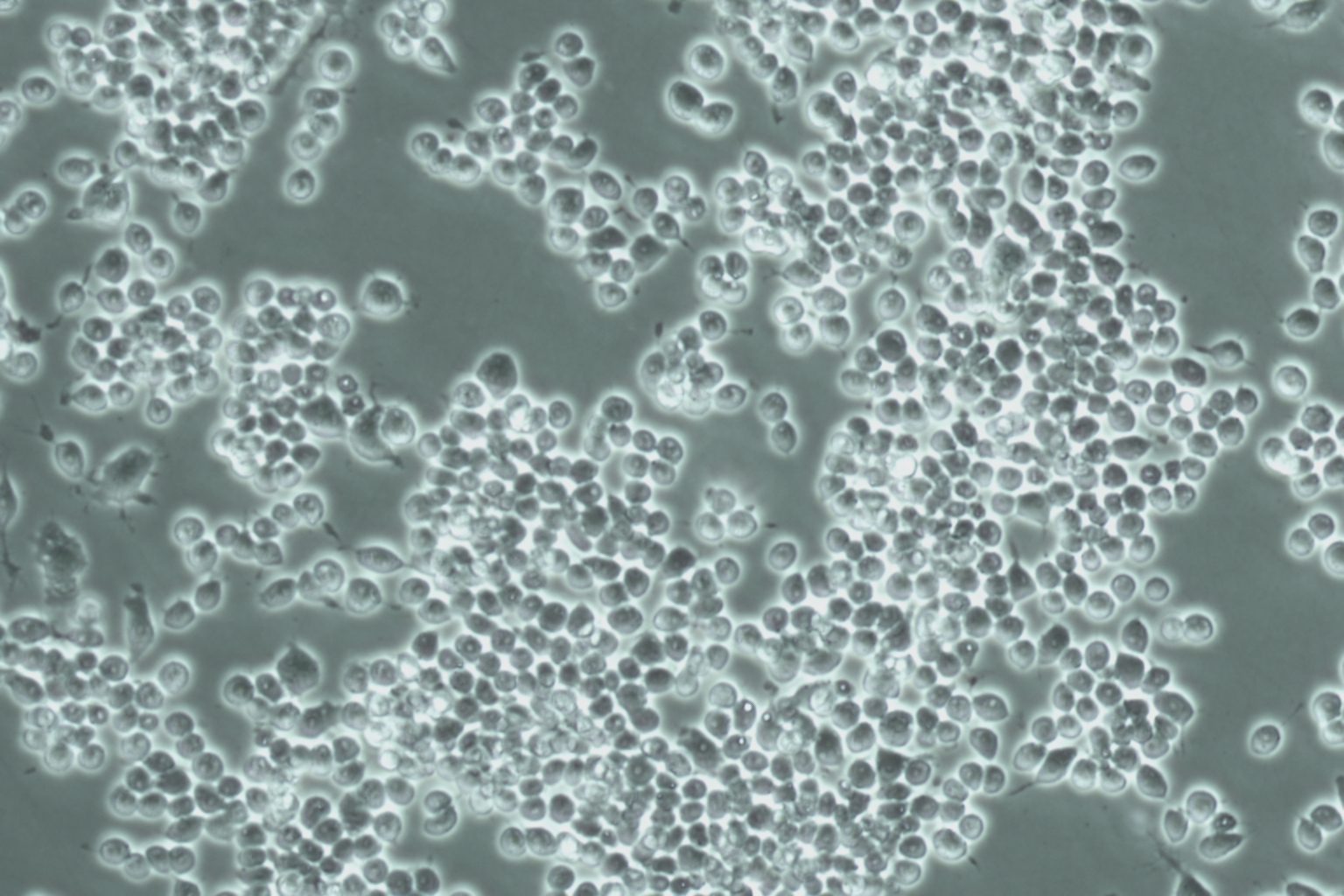
3-1: TRAP 染色:根据密度梯度培养结果将RAW264.7细胞以5x10^3/cm²的密度接种到48孔板中,用50ng/ml的高浓度RANKL诱导破骨细胞,并于24、48、72、96小时分别进行TRAP染色,观察破骨细胞形态变化。同样密度将RAW264.7细胞接种到48孔板中,设置对照组与不同RANKL浓度诱导组,过夜贴壁后,对照组正常培养,未加任何处理,诱导组分别加用5、10、20、50ng/mI的RANKL诱导破骨细胞,每2天换液。4天后镜下观察到融合的破骨细胞取出48孔板,去除培养液,进行 TRAP 染色;
Raw264.7TRAP 染色,分别是4X,10X,100X拍摄
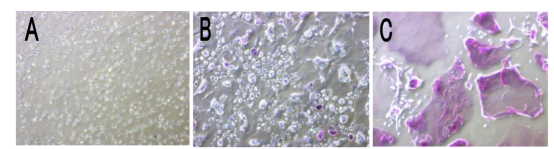
3-2:破骨细胞吸收功能检测实验 RAW264.7细胞以5x10^3/cm²的密度接种于24孔骨细胞培养板中,设立对照组与诱导组,对照组正常培养,未加任何处理,诱导组加20ng/ml的RANKL诱导破骨细胞,换液2天/次,诱导4天后拿出骨细胞培养板,移除培养液,dd水洗第1遍,加人4%的次氯酸钠漂洗5min,移除次氯酸钠,用dd水冲洗第2遍,加人1%的甲苯胺蓝染色10min后,dd水洗第3遍,室温晾干,光镜下进行观察拍照。
RAW264.7诱导成破骨细胞的甲苯胺蓝染色
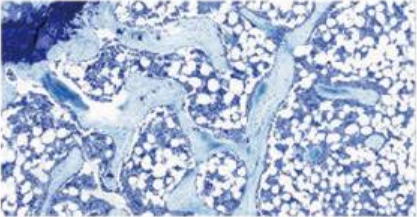
3-3:骨吸收实验:RAW264.7细胞经诱导4天后骨细胞培养板上出现大量的圆形、椭圆形、不规则形状的白色吸收瘢痕,对照组未见吸收瘢痕
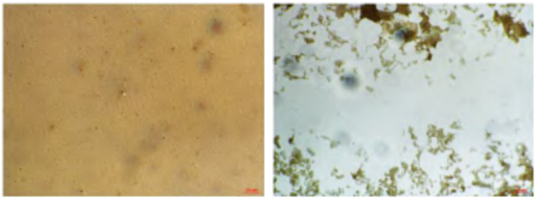
对照组 诱导组
Raw264.7细胞炎症模型构建
构建炎症模型对RAW264.7细胞的形态没有要求,终于不用在乎细胞是否长角了
1.细胞铺板:以96孔板为例,选择生长状况良好的小鼠巨噬细胞RAW264.7消化,离心后重悬计数,选择合适的细胞浓度稀释(2~3x10^4/孔)
2、铺板:将重悬好的细胞液倒入加样槽中,吹打细胞,混匀加样,每孔加入100 ul,2~3列加样后重新吹打均匀(细胞易沉降),边缘孔每孔加入100ulPBS.
3、放入细胞培养箱,5 % CO2、37'C条件下继续培养过夜
4、配药:样品A,配制10 mg/mL溶于1 mL无菌水;样品:B.C,配制10mg/mL溶于1ml DMSO,分别用高糖DMEM(含10%FBS)稀释成不同浓度(0.2、0.5、5.0、1.0和10ug/mL)
5、将96孔板过夜培养后将完全培养液倒出,按设置的浓度梯度加药,每个浓度设置3个重复样,培养 24 h。
6、将已加药培养过夜(加药时细胞接近平铺满孔底)的 96 孔板中培养基吸出,每个孔中加入50 μL亚甲基蓝染液。
7、放入细胞培养箱孵育 1小时后取出,洗去亚甲基蓝染色液。
8、测 OD 值:每孔加100ul洗脱液,培养液震荡15 min,放入酶标仪,继续.荡3 min后595 nm 波长读数。
9分析数据,需要先得出对照组的平均值,各个实验数据/对照平均值x100%得出细胞存活率,算出各个数值之间的偏差,分析。
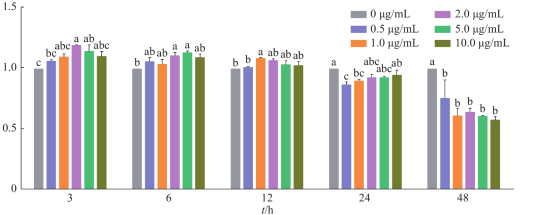
不同质量浓度脂多糖对RAW264.7细胞活力的影响
文末彩蛋,即日起到7月底 20株细胞618元促销: