近年来,CAR-T细胞疗法已在癌症治疗领域取得重大突破,然而其在T细胞恶性肿瘤治疗方面仍面临挑战。其主要的障碍是恶性T细胞和正常T细胞共表达多数靶向抗原,当病变细胞是T细胞时,特定的靶点也存在于CAR-T细胞当中,因此CAR-T细胞会出现自相残杀的现象,从而阻碍建立以T细胞源性肿瘤为靶点的CAR-T细胞平台。CD7是T细胞表面一个非常稳定的标志物,其在T淋巴细胞的表达率约为95%,靶向CD7的免疫治疗可以覆盖大多数类型的T细胞恶性肿瘤,但自相残杀影响了CD7 CAR-T细胞的增殖,因此CD7 CAR-T疗法的开发目前尚存在一定的困难。
2023年6月30日,浙大医学院古莹/孙洁研究团队在Leukemia (IF 11.4) 发表题为“Inserting EF1α-driven CD7-specific CAR at CD7 locus reduces fratricide and enhances tumor rejection”的研究论文。文章开发了一种“二合一”的策略,通过同时敲除CD7和敲入CD7 CAR,将CD7 CAR直接插入CD7位点,不仅减少了CD7 CAR-T细胞的自相残杀,而且增强了肿瘤排斥反应,为临床CAR-T治疗T细胞恶性肿瘤提供了新思路。

维真助力
本研究CD7 CAR特异性敲入所使用的AAV病毒载体(体外感染 MOI=1×106)由维真生物助力提供!
01研究结果
1、利用2合1策略制备具有稳健扩增能力的CD7 CAR-T细胞
作者首先构建了三种CD7 CAR-T细胞(3A1F、TH69及T3-3A1),并证明3A1F和TH69 CAR-T细胞在抗原刺激下表现出强大的细胞毒性和强劲的细胞因子分泌,但由于自相残杀而无法在体外扩增。以往研究表明通过基因编辑敲除CAR-T细胞表面的CD7和TCR,即制备不表达CD7的CAR-T细胞可以减少自相残杀,但实验方法均是用慢病毒或逆转录病毒制备CD7 CAR-T细胞,CAR基因的半随机整合可能会破坏正常基因的表达。此外,最近研究表明通过CRISPR/Cas9将CD19 CAR插入TRAC位点可减少CAR介导的tonic信号并增强肿瘤排斥反应。基于上述研究,作者开发了一种2合1策略,利用CRISPR/Cas9技术和AAV病毒载体(维真生物助力)通过同时敲除CD7和敲入CD7 CAR,将CD7 CAR直接插入CD7位点,生成了能够稳健扩增的CD7KO&KIEF1α CAR-T细胞。随后比较了三类CD7KO CAR-T细胞(CD7敲除的RV介导的CAR随机整合T细胞、CD7敲除的TRAC位点CAR特异性整合的T细胞及CD7KO&KIEF1α CAR-T细胞)的体外效应功能。经分析,三种CD7KO CAR-T细胞对Jurkat细胞系均具有相似的细胞毒性,并且均表现出强劲的细胞因子分泌,并对原代T-ALL细胞也表现出强大的效应功能。
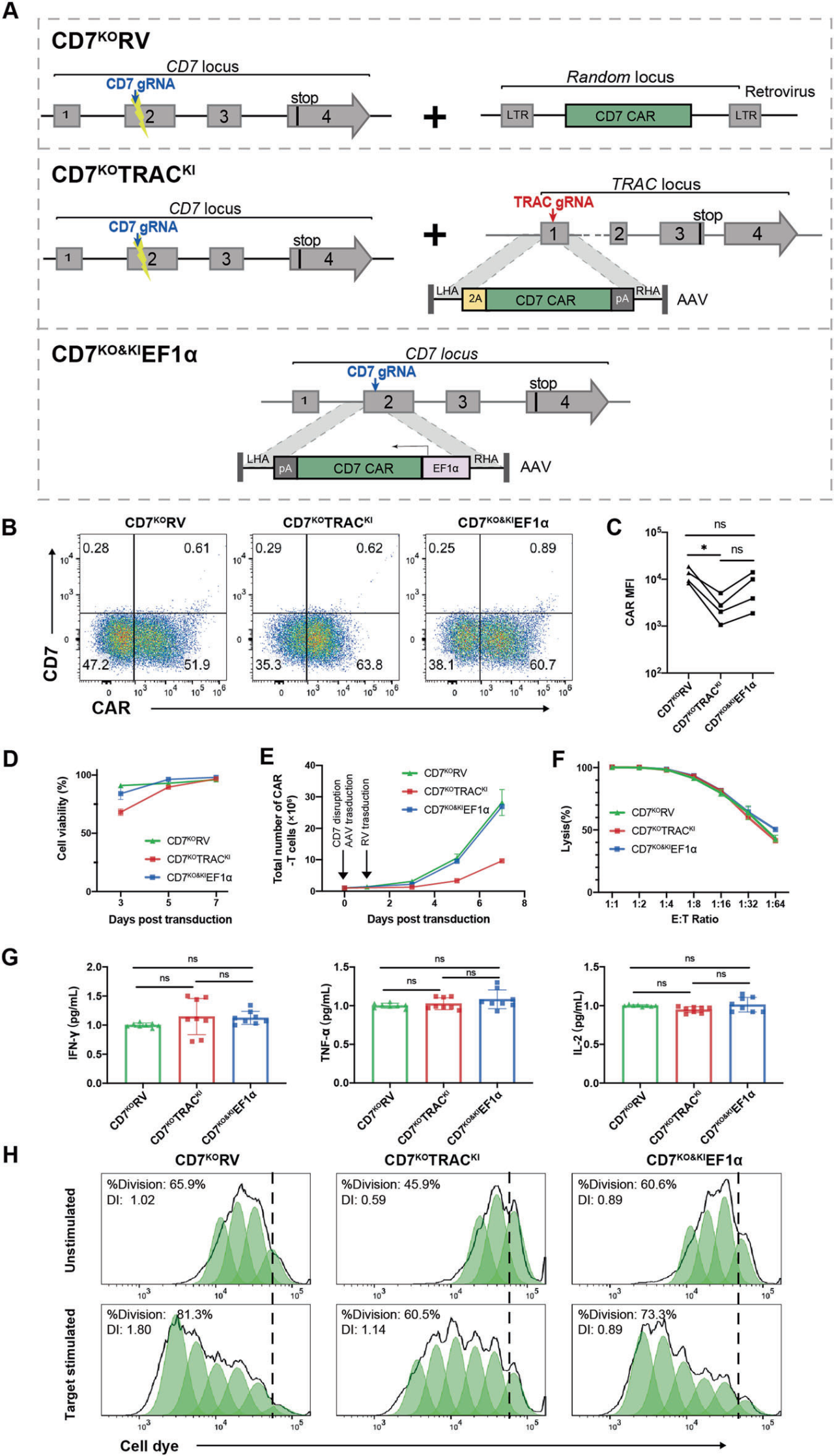
图1. 2合1策略制备可扩增的和功能性的CD7KO CAR-T细胞
2、两种位点特异性敲入CAR-T细胞在小鼠T-ALL异种移植模型中具有更强的保护作用
作者比较了三种CD7特异性CAR-T细胞的体内抗肿瘤功能,分别向T-ALL小鼠模型注射三种类型CAR-T细胞或未转导CAR的T细胞(1×106 cells ),比较不同CAR-T细胞的效果。结果显示三种CD7 CAR-T细胞均可以延缓T-All的进展并延长小鼠的中位生存期,更具体来看,用位点特异性敲入CAR-T细胞(CD7KOTRACKI或CD7KO&KIEF1α细胞)治疗的小鼠比用逆转录病毒转导的CAR-T细胞治疗的小鼠显示出更长的中位生存期,并且CD7KO&KIEF1α组的整体肿瘤根除率略优于CD7KOTRACKI组。
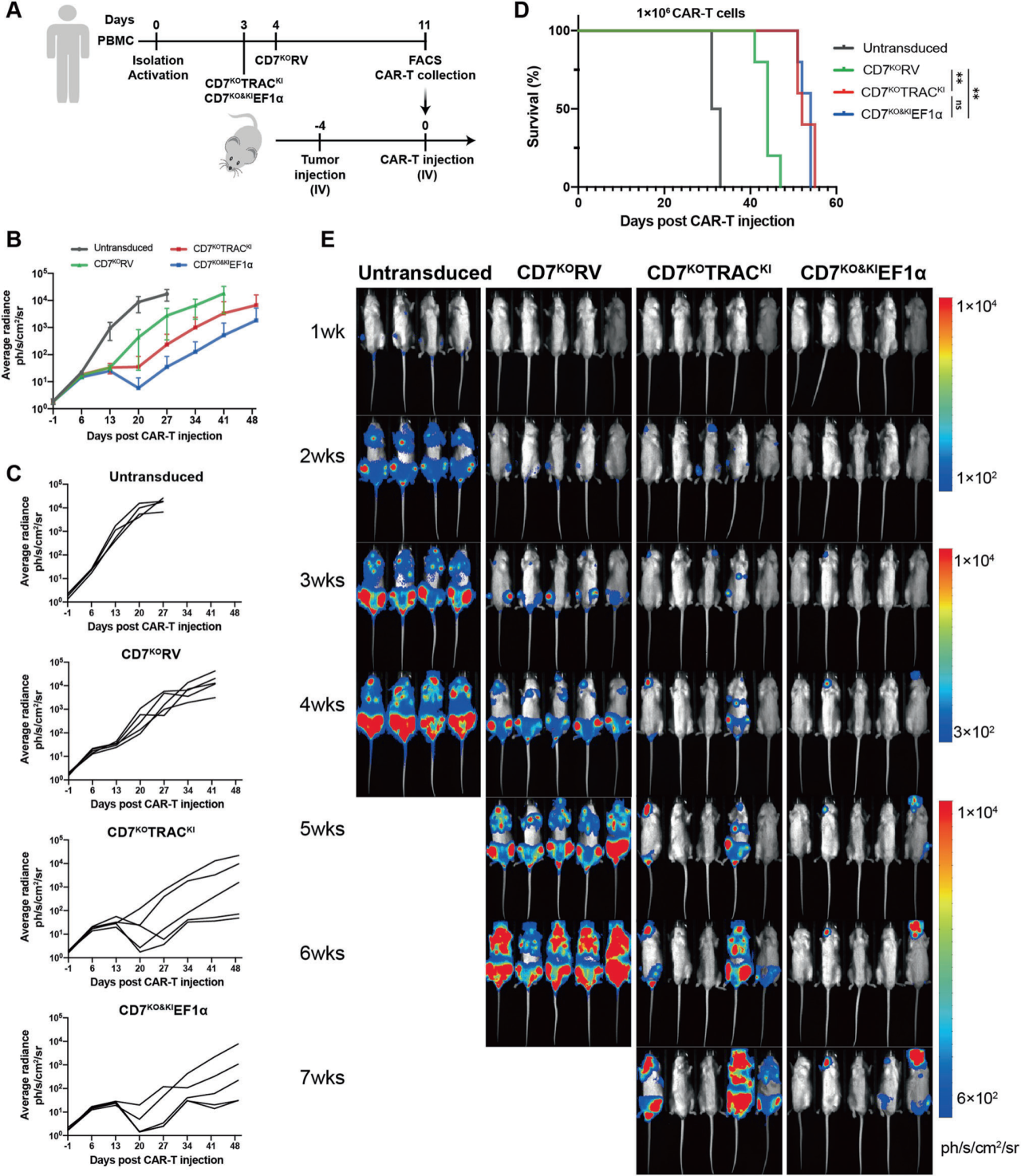
图2. 小鼠异种移植模型中,CD7KO CAR-T细胞抑制T-ALL的进展
3、利用2合1策略制备具有抗肿瘤活性的CAR-NK细胞
由于健康T细胞和恶性T细胞较难区分,在分离自体T细胞制造针对T细胞恶性肿瘤的CAR-T细胞时,易导致产品污染。NK细胞可以有效地从T细胞中分离出来,因此使用NK细胞能在很大程度上避免这一问题。但NK细胞也表达CD7,会导致CAR-NK细胞的自相残杀。因此作者试图使用2合1 CD7KO&KI策略来设计CD7特异性的CAR-NK细胞。CD7KO&KIEF1α CAR-NK细胞对Jurkat细胞表现出高效的细胞毒性以及强劲的细胞因子分泌。体内实验表明,CAR-NK具有有效的抗Jurkat肿瘤活性,并对难控制的CCRF-CEM肿瘤表现出强大的效应功能。上述结果表明将EF1α驱动的CD7 CAR插入CD7位点是一种可行的策略,在T细胞和NK细胞中均有效。
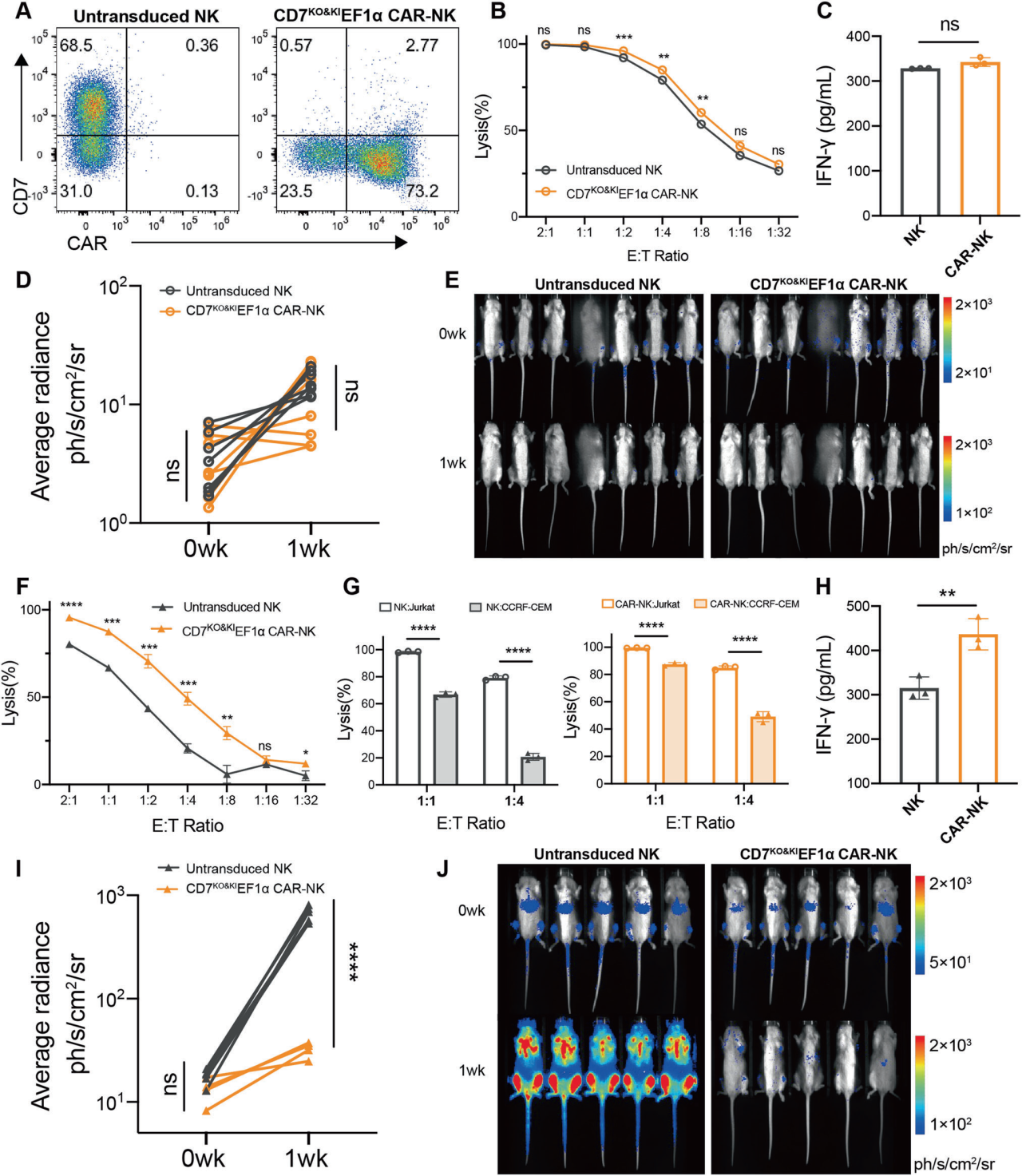
图3. 2合1策略产生具有抗肿瘤活性的CAR-NK细胞
02小结
综上所述,作者开发了一种2合1敲除和敲入策略,通过在EF1α启动子的控制下,在CD7位点表达CD7 CAR,减少了CAR-T和CAR-NK细胞的自相残杀,增强了二者对T-ALL肿瘤的排斥反应。CD7KO&KI经济有效且风险较低,是开发自体CD7特异性CAR-T细胞的可选策略。
