
编者按
人体肠道类器官(hIOs)由于具有自我更新和分化能力,可以模拟肠道的简化结构和功能。因此,hIOs已成为研究人类肠道发育和功能特性的体外模型系统。然而,由于肠道干细胞来源的类器官结构不规则,且在可重复性和大规模培养的方面受到限制,因此不具有广泛实用性。
标准化的肠道干细胞(ISCs)培养方法可为培养同质、规模化的肠类器官提供合理的解决方案,ISCs在体外可以迅速扩增,是最有前途的肠上皮再生移植细胞来源。因此体外培养的ISC可以作为模型系统来研究ISC生物学和基因编辑细胞来源,从而可以作为成功模拟人类肠道的正常生理和病理的体外模型。
气液培养(ALI)在类器官培养方面日益增多,在气液培养中,基态干细胞繁殖稳定,基因组不稳定,容易高效地分化为肠上皮细胞,更好的模拟体内肠道功能。将ISC与气液培养相结合,稳定产生突出绒毛样结构的2.5D肠上皮模型。该技术为研究人类ISC及其在再生医学和疾病建模方面的潜在应用提供了强有力的工具。
2024年1月27日 ,韩国科技大学韩国生物科学和生物技术研究所(KRIBB)的Mi-Young Son研究团队在Nature Communications(IF=16.6)上发表了最新研究成果,该研究建立了一种在新条件下扩增的人肠道干细胞(ISC)培养方法,结合在最低限度培养基中的气液界面培养,使ISC3D-hIO分化为具有细胞多样性、绒毛样结构和屏障完整性的肠上皮,且ISC3D-hIO是基因编辑研究ISC生物学和肠道疾病移植的理想细胞源,可以为再生医学和疾病建模提供了一种生物工具。
文章题目
Chemically-defned and scalable culture system for intestinal stem cells derived fromhuman intestinal organoids
杂志:Nature Communications(IF=16.6)
发表时间:2024.1.27
作者:Mi-Young Son等
单位:韩国科技大学韩国生物科学和生物技术研究所(KRIBB)
01、研究结果
1. 成功建立无需饲养层的人源ISC
为了建立一种获得可持续培养ISCs的方法,研究者从人多能干细胞(hPSC)衍生的3D hIO中分离出ISC3D-hIO,并且测试了几种类型的细胞外基质(ECM)来代替饲养层细胞,发现ISC3D-hIO与明胶或I型胶原相比,在涂有1%基质凝胶的表面上可以更有效地生长和增殖。
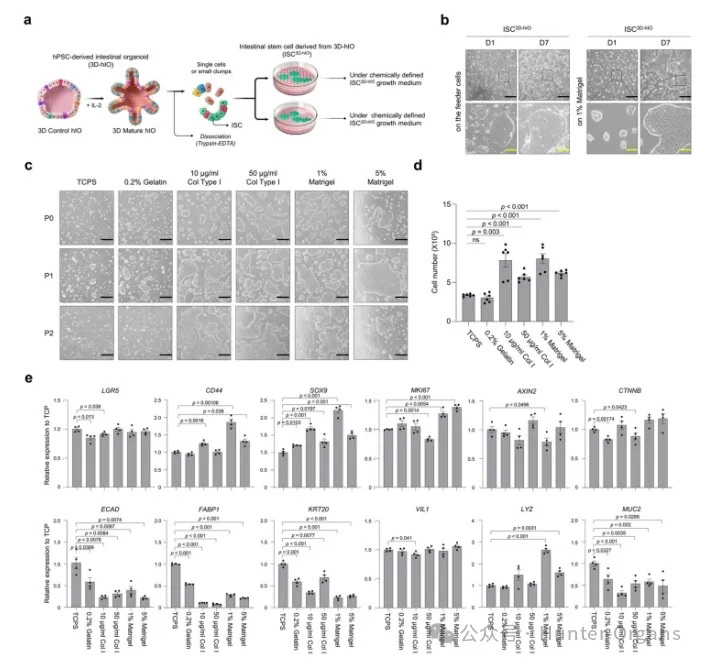
图1
为了优化ISC3D-hIO分离和扩增的生长培养基,研究者们评估了先前报道的参与体外人类结肠隐窝维持的各种生长因子和调节因子的组合,发现在培养基中添加RSPO1、EGF和PGE2对于ISC3D-hIO培养是必不可少的,因此制定了化学培养成份确定的ISC3D-hIO培养基对细胞进行进一步培养。
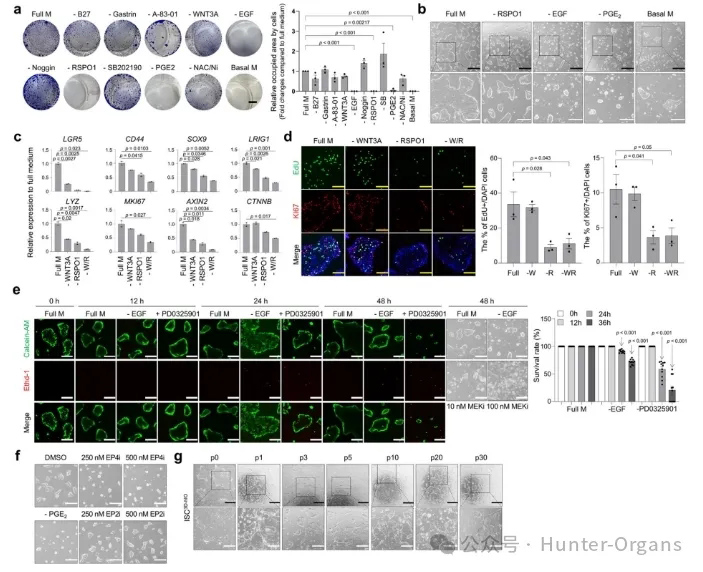
图2
2. 单细胞分辨率下ISC3D-hIO细胞组成分析
为验证上一步分离扩增出来的细胞准确类型,以便于实验的下一步进行。研究者们通过单细胞RNA测序(scRNA-seq)系统对ISC3D-hIO的细胞组成进行了分析。通过对上皮细胞标记物(EPCAM、CDH1)和间质细胞标记物(MFAP4、COL1A2、DCN)、细胞周期以及与胎儿ISC标记基因(LDHB、EIF3E、SOX9和SHH)的表达对比研究发现,研究者们提取出的 ISC3D-hIO细胞主要由干细胞和祖细胞组成,且分化的细胞相对较少。
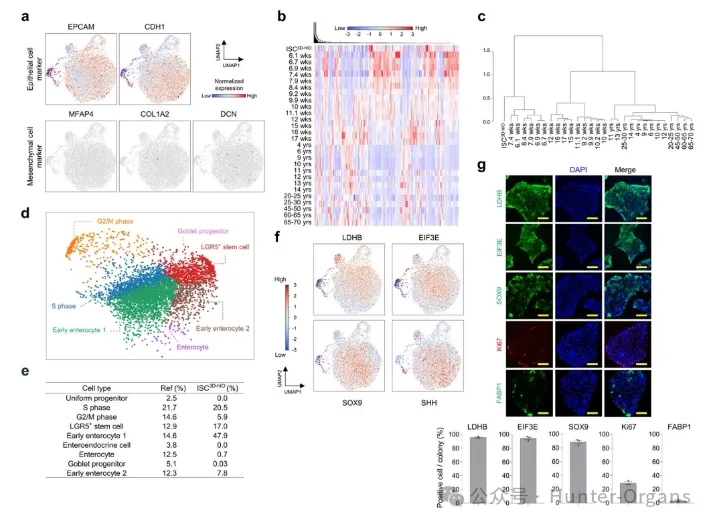
图3
3. 采用气液界面(ALI)培养向2.5D肠上皮分化
体外肠上皮培养物与体内的人肠组织形态功能相似,便于在体外进行肠道功能的分析和应用。在Transwell中将ISC3D-hIO进行ALI培养,使其分化为具有绒毛样突出结构的肠上皮,建立具有人肠道结构和细胞多样性等特性的体外培养模型。
在特定的营养条件下,ISC3D-hIO所表达的分化标志物表达逐渐提升,且衍生的上皮形成绒毛图案,HE染色切片显示,随着ALI培养时间的延长,绒毛样皱襞的厚度显著增加,最终形成完整的上皮。通过分析ISC3D-hIO和ALI条件下培养的ISC3D-hIO细胞的相关成熟分化的RNA-seq数据,对比发现在ALI条件下,ISC3D-hIO具有分化为功能性肠上皮的能力,且分化程度高于正常条件下培养的ISC3D-hIO。
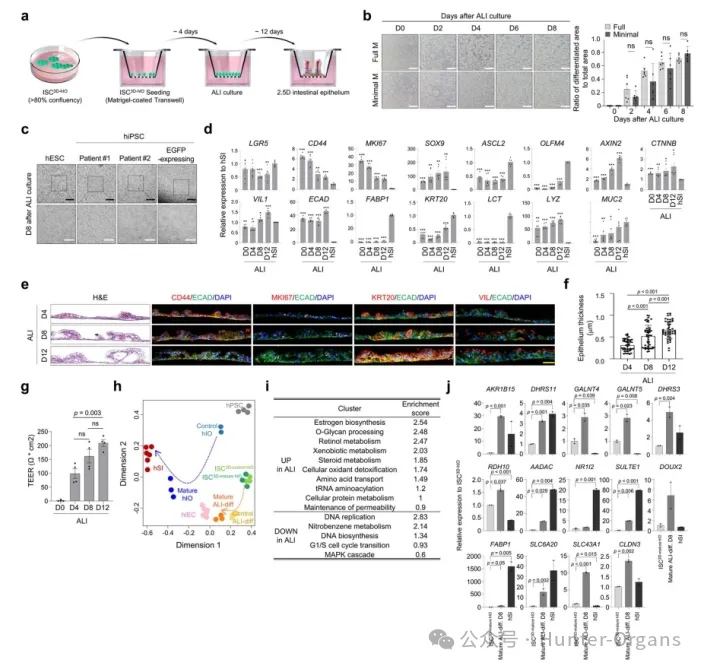
图4
4. ISC3D-hIO在基因编辑和移植中的应用
ISC3D-hIO生长迅速,在可控的条件下进行培养,适合用于各种应用研究。为了研究新模型的适用范围,研究者们使用慢病毒基因转导来创建转基因ISC3D-hIO细胞系。对基因转导之后的细胞进行筛选,并通过ALI培养可以顺利分化为可以被标记的3D hIOs和2.5D肠上皮模型,结果表明,ISC3D-hIO可以应用于基因组编辑技术构建稳定的细胞系。
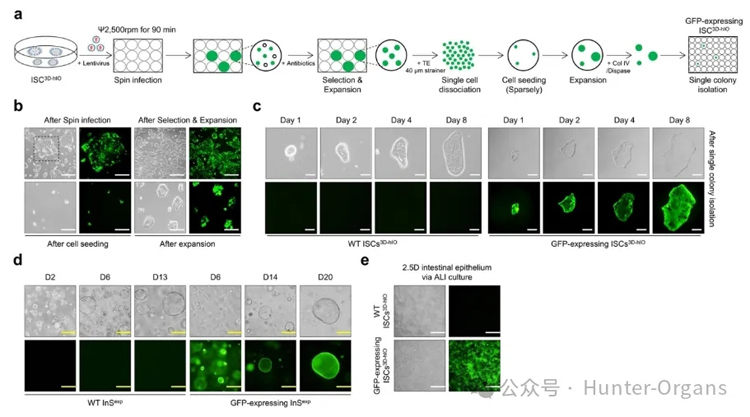
图5
为进一步研究肠上皮模型的应用价值,研究者们将ISC3D - hIO移植到EDTA损伤的NOD/SCID缺失IL2Rg基因(NIG)小鼠的结肠上皮中,观察2周以评估其再生潜力。结果显示,ISC3D-hIO移植组在原位表现活跃,肠道重量以及损伤程度均有改善,在植入部位有隐窝结构形成。表明ISC3D-hIO是一种可植入的组织再生来源,能够形成肠上皮结构。
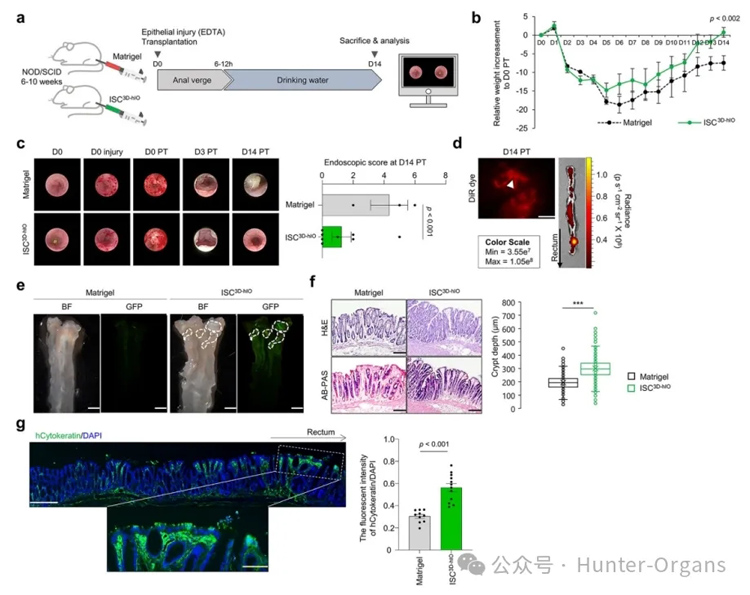
图6
5. 严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)感染ali分化肠上皮的模型研究
为证明ALI培养产生的2.5D肠上皮是模拟宿主-病原体相互作用关键方面的合适模型,因此研究者们试图使用2.5D肠上皮生成SARS-CoV-2病毒感染模型。
结果显示,每个ISC3D-hIO保留了其起源hIO的肠道成熟特异性基因表达图谱,ISC3D -成熟的hIO肠上皮比ISC3D -控制的hIO肠上皮更容易受到病毒感染,而且当使用可以破坏ACE2与SARS-CoV-2相互作用的化学药物治疗时,前者的受病毒感染情况得到更多的改善。因此,2.5D肠上皮模型,更适合研究宿主-病原体之间的相互作用。
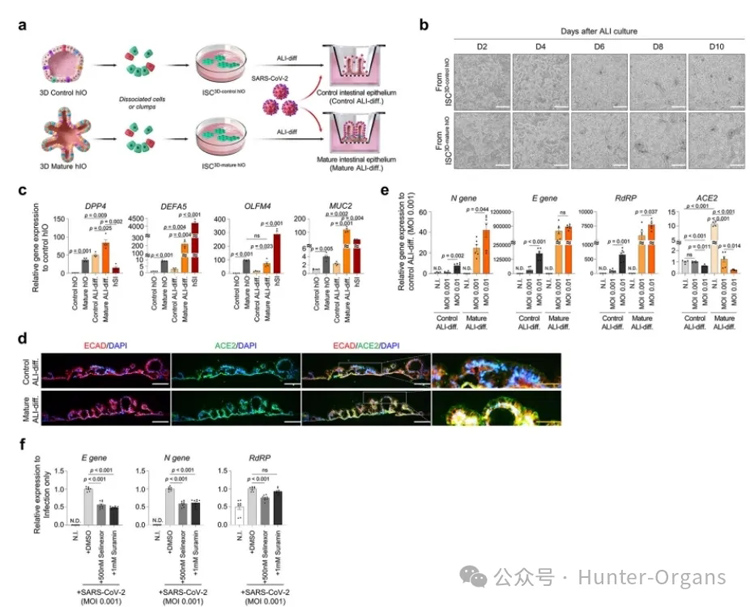
图7
02、编者点评
综上,本研究开发了一种源于3D人肠肠道类器官(3D-hIO)的2D单层人ISC培养技术,在化学成分完全确定和无滋养层细胞的情况下,细胞主要由干细胞和前体细胞组成,R-spondin 1(RSPO1)、表皮生长因子(EGF)和前列腺素E2(PGE2)补充剂对细胞存活和增殖至关重要。该技术为研究人类ISC以及在再生医学和疾病建模中的潜在应用提供了强大工具。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!
