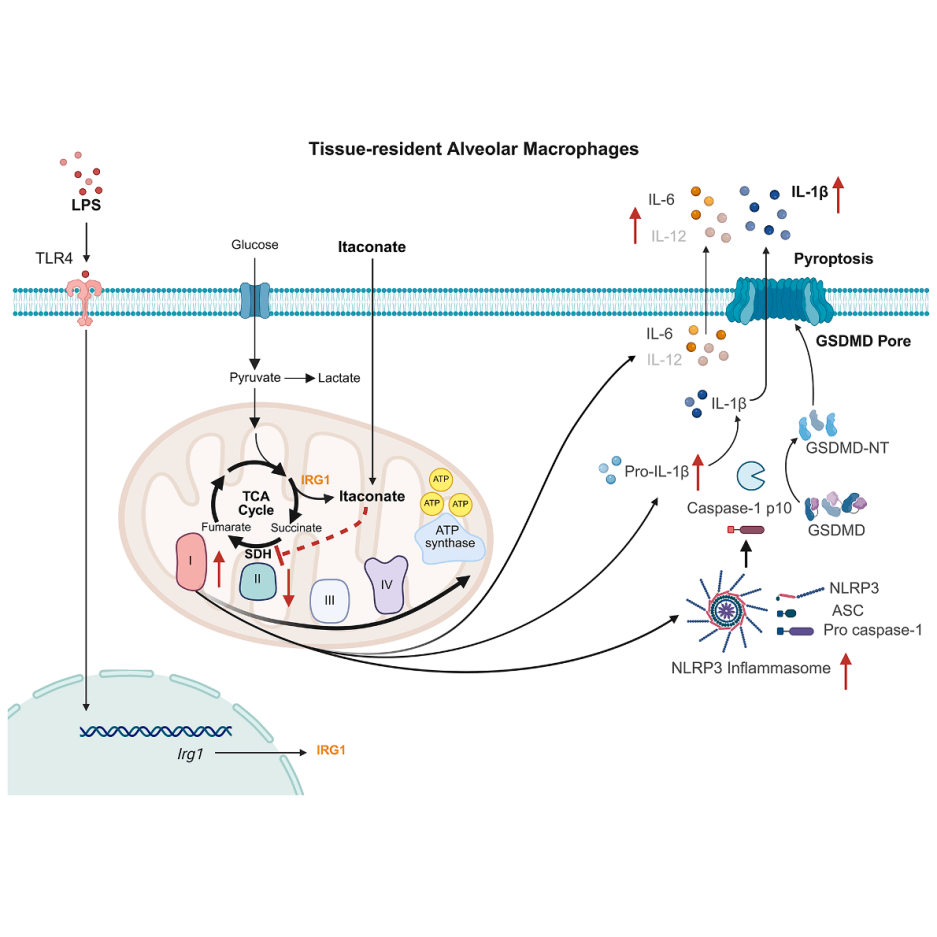
在炎症性疾病的研究中,衣康酸(Itaconate)已被证明是一种具有潜力的抗炎代谢物,长期以来其免疫调节功能的阐述主要基于科学家对离体培养的骨髓来源巨噬细胞(BMDMs)或细胞系的研究:衣康酸可抑制促炎细胞因子(如IL-6、IL-12)的产生,并抑制NLRP3炎症小体的激活,因而被视为多种炎症性疾病(如脓毒症、肺纤维化、COVID-19)的潜在治疗靶点。然而,这类研究忽视了一个关键问题:在体内独特微环境中组织驻留巨噬细胞(如肺泡巨噬细胞(AMs):是肺部驻留的固有免疫细胞,起源于胚胎前体细胞,依赖局部微环境维持表型,在宿主防御和肺组织稳态中起核心作用。与BMDMs相比,AMs的代谢特征更依赖线粒体氧化磷酸化(OXPHOS),且其功能受肺泡低葡萄糖微环境等因素严格调控)对衣康酸的反应如何尚不明确。
2025年6月,同济大学大学附属东方医院呼吸与危重症医学科王飞龙/郭忠良/李强教授团队在Cell Metabolism上在线发表题为“Itaconate promotes inflammatory responses in tissue-resident alveolar macrophages and exacerbates acute lung injury”的研究文章,通过代谢组学、单细胞测序等技术揭示了衣康酸可促进AMs中促炎细胞因子(如IL-6、IL-1β)的释放,并增强NLRP3炎症小体激活。肺泡微环境作为这一差异的核心驱动因素——将BMDMs移植至肺泡腔后,其对衣康酸的反应发生逆转。此外,衣康酸衍生物(二甲基衣康酸、4-辛基衣康酸)在AMs中表现出抗炎效应,与天然衣康酸作用相反。体内外实验证实,衣康酸会加剧急性肺损伤,表明其临床应用前需系统评估在不同组织驻留巨噬细胞中的作用。(麦特绘谱提供[U-13C5]-Glutamine代谢流技术检测服务)
研究设计
小鼠模型:基因敲除(Irg1⁻/⁻、Nrf2⁻/⁻、Gsdmd⁻/⁻)小鼠,气管内注射LPS诱导急性肺损伤(ALI)小鼠
组学分析:代谢组学、单细胞测序
研究思路
图1. 思路图
研究结果
1. Toll样受体4激活诱导AMs中IRG1表达和衣康酸产生
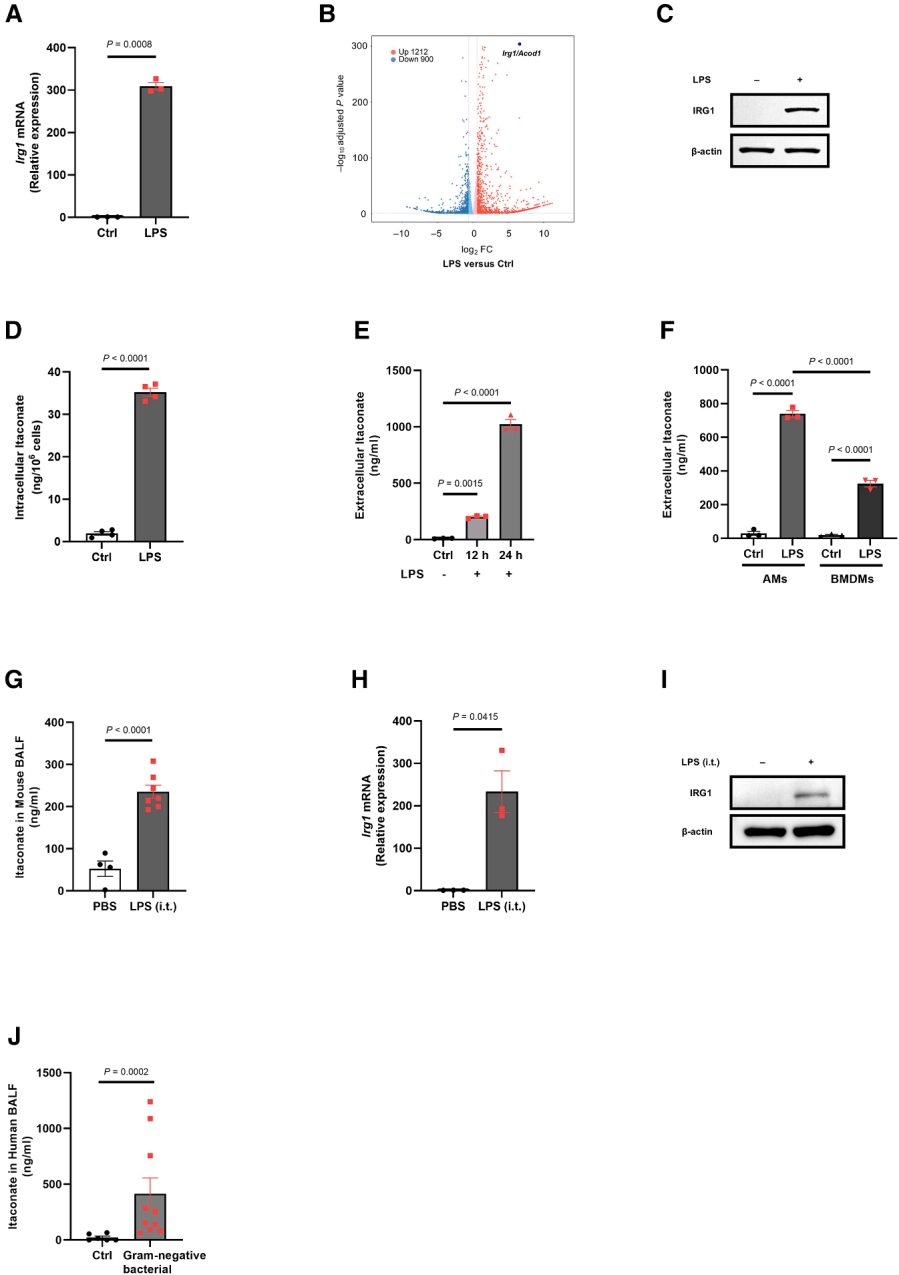
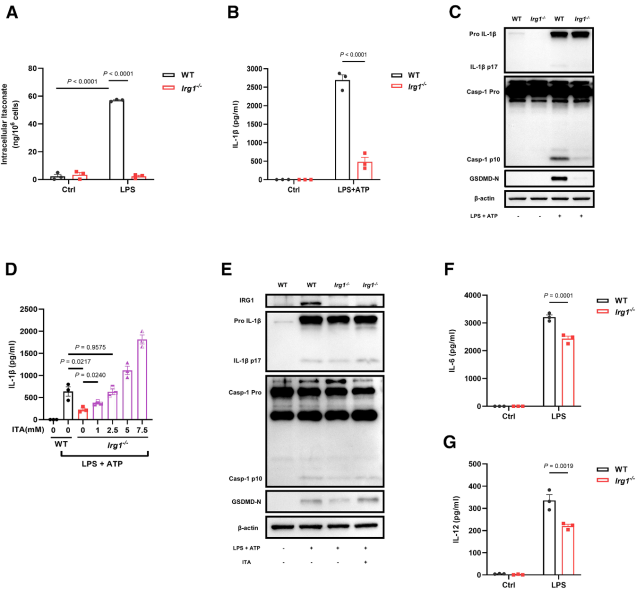
为探究衣康酸在AMs免疫调节中的作用,研究首先验证LPS通过Toll样受体4(TLR4)激活是否能诱导衣康酸合成酶免疫响应基因1(IRG1)的表达。从小鼠肺中分离AMs,体外经LPS刺激后,发现Irg1mRNA水平较对照组升高约300倍。RNA-seq进一步证实,Irg1是LPS激活AMs中诱导最显著的基因之一。蛋白质水平上,LPS刺激可诱导IRG1表达。代谢分析显示,AMs在LPS刺激后胞内和培养上清液中的衣康酸含量显著增加,且其分泌量较骨髓来源巨噬细胞(BMDMs)高近2倍。在LPS诱导的急性肺损伤小鼠模型中,气管内注射LPS后,支气管肺泡灌洗液(BALF)中的衣康酸水平显著高于PBS对照组。上述结果表明AMs在TLR4介导的炎症激活过程中可显著表达Irg1并合成衣康酸。
图2.Toll样受体4激活诱导AMs中IRG1表达和衣康酸产生
2. 衣康酸促进AMs产生炎性细胞因子
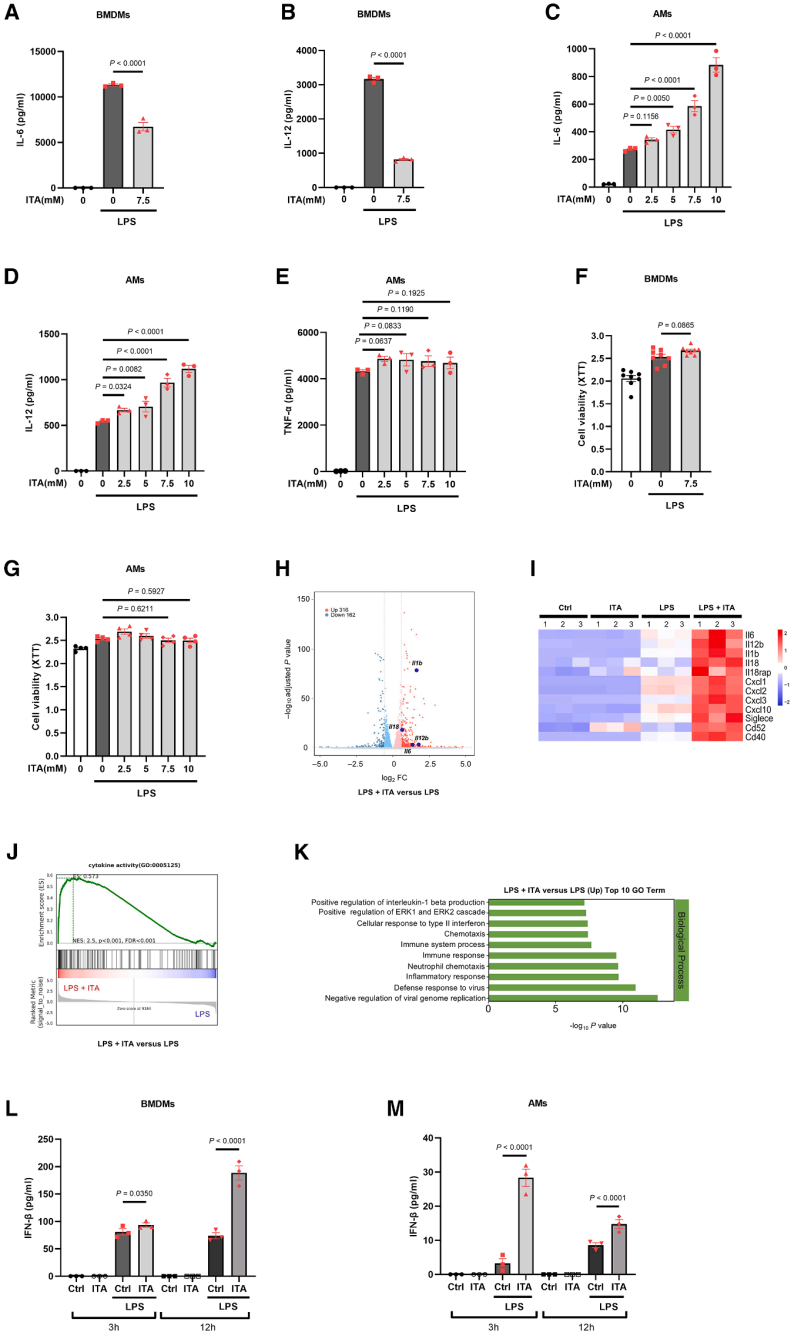
基于AMs在LPS体外和体内刺激后,在Irg1表达和衣康酸产生的诱导方面表现出与BMDMs相似的行为,接下来研究衣康酸在AMs中的免疫调节功能是否同样具备抗炎作用。衣康酸预处理BMDMs可抑制IL-6、IL-12等促炎因子产生,而在AMs中呈剂量依赖性促进作用,且不影响TNF-α水平。细胞活力检测显示,衣康酸对两种细胞均无毒性。RNA-seq分析表明,衣康酸处理的AMs中IL-6、IL-1β、IL-18等促炎细胞因子及CXCL1/2/3/10趋化因子基因表达显著上调。基因集富集分析(GSEA)显示,衣康酸处理与AMs的细胞因子活性及免疫反应通路显著相关,证实其在AMs中的促炎效应。衣康酸在BMDMs中需12小时预处理才显著增强IFN-β生成,而在AMs中仅需3小时预处理即可显著促进IFN-β释放,12小时处理效果减弱,表明两类细胞对衣康酸的时间依赖性反应存在差异。上述结果证实衣康酸在肺泡巨噬细胞中具有促炎功能,激活包括IL-1β与IL-18在内的多种炎性因子和趋化因子,同时调控IFN-β信号通路。
图3. 衣康酸促进AMs产生炎性细胞因子
3. 衣康酸促进AMs中NLRP3炎症小体的活化
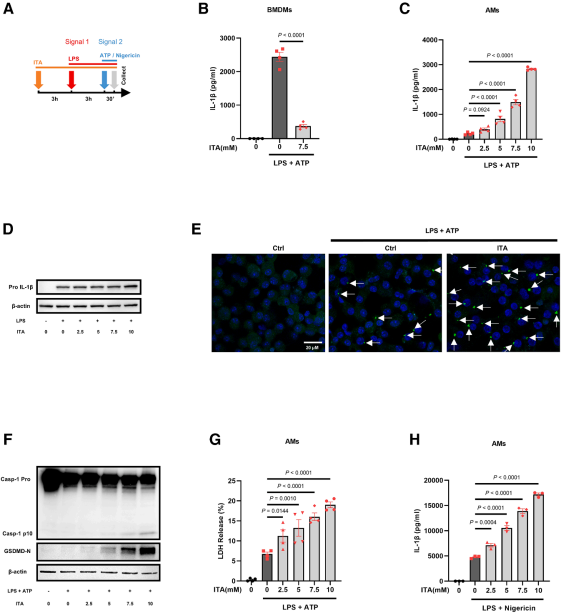
既往研究表明衣康酸可抑制BMDMs中NLRP3炎症小体激活,使用相同实验方案(衣康酸预处理+LPS+ATP刺激),结果显示衣康酸抑制BMDMs中IL-1β的产生,却剂量依赖性促进AMs中IL-1β生成与分泌。在NLRP3炎症小体通路中,成熟IL-1β的生成受两个信号步骤控制:第一个为原IL-1β的诱导表达(priming,信号1),第二个为炎症小体的激活并介导其剪切成熟(activation,信号2)。为明确衣康酸是否影响其中某一步骤,结果显示只有在较高剂量下,衣康酸才能促进AMs中原IL-1β(pro-IL-1β)表达,而在低剂量时能显著促进成熟IL-1β生成,提示其主要作用可能集中在激活步骤。通过ASC-citrine(计数ASC斑点形成的数量,可以定量评估NLRP3炎症小体的激活程度)标记可见,衣康酸增强AMs中ASC斑点形成,伴随caspase-1/GSDMD的剪切活化,并诱导细胞焦亡。
通过对比野生型(WT)和Irg1⁻/⁻肺泡巨噬细胞(AMs),证实内源性衣康酸(由IRG1介导合成)可增强NLRP3炎症小体活化,促进IL-1β成熟及caspase-1/GSDMD剪切活化,而外源补充衣康酸可逆转Irg1⁻/⁻AMs的缺陷。但衣康酸对LPS诱导的IL-6/IL-12影响较小,提示其促炎作用集中于炎症小体通路。上述结果表明衣康酸对不同巨噬细胞亚群的免疫调节具有显著异质性。
图4. 衣康酸促进AMs中NLRP3炎症小体的活化
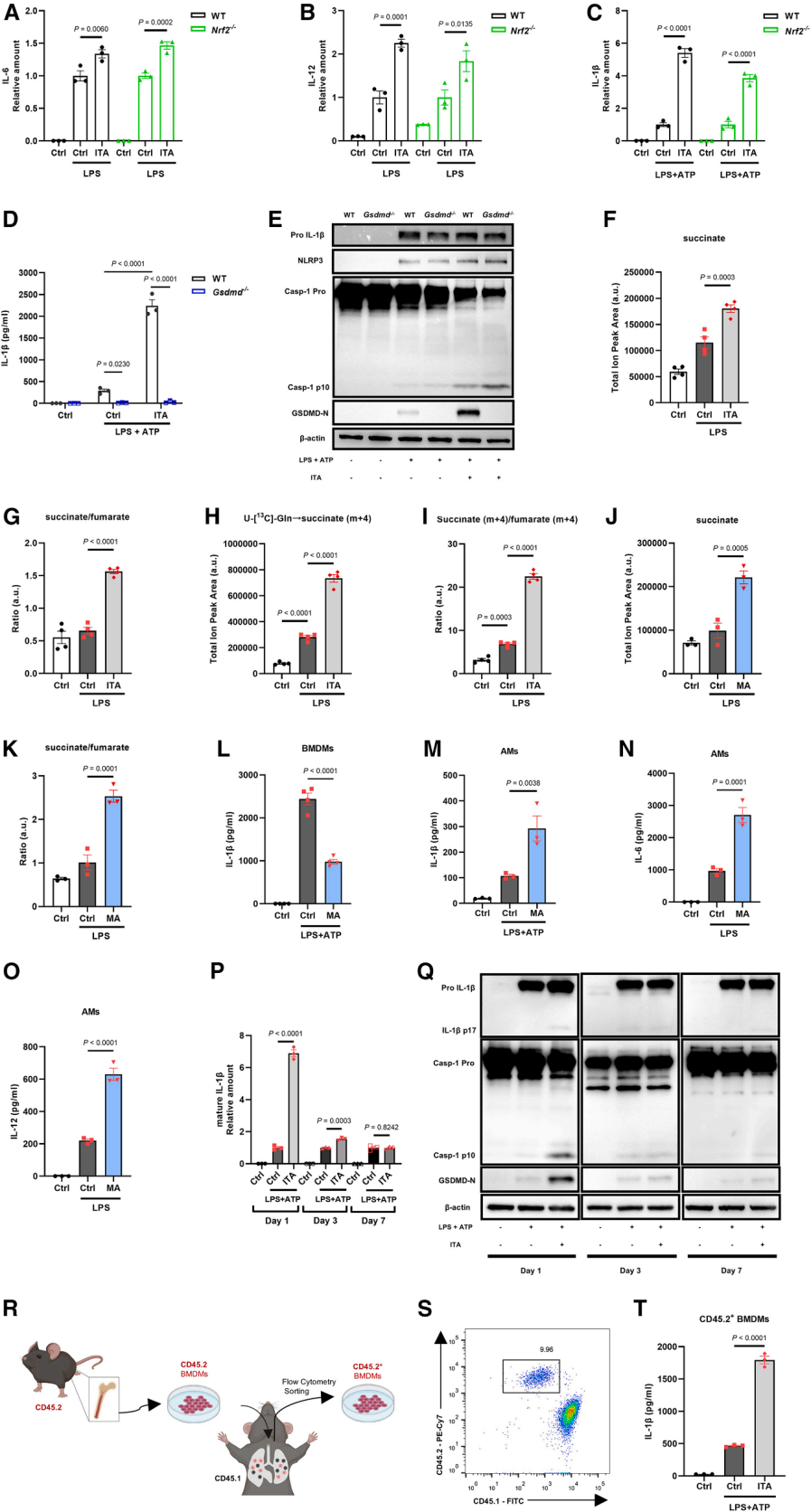
4. 衣康酸的促炎活性不依赖于NRF2与GSDMD通路,而与SDH抑制密切相关
为进一步探究衣康酸在AMs中诱导促炎反应的机制,对NRF2(转录因子,衣康酸调控的经典靶点之一)、GSDMD(细胞焦亡过程中的关键蛋白)、SDH(琥珀酸脱氢酶)进行聚焦,发现在Nrf2⁻/⁻AMs中,衣康酸仍促进IL-6/IL-12表达及NLRP3活化,Gsdmd⁻/⁻AMs中,衣康酸虽阻断IL-1β分泌,但能增强caspase-1剪切,提示其直接激活NLRP3。
作为与琥珀酸、富马酸、丙二酸结构相似的代谢物,衣康酸可与SDH竞争性结合并抑制其活性。实验结果显示,LPS处理的AMs在衣康酸处理后,其琥珀酸水平显著升高,琥珀酸/富马酸比例也随之上升,利用稳定同位素示踪(麦特绘谱提供代谢流技术检测),进一步确认衣康酸处理可显著提升[U-13C5]-谷氨酰胺标记的琥珀酸水平及其与标记富马酸的比值,明确了其对SDH的抑制效应。通过SDH抑制剂丙二酸重现了衣康酸的促炎作用,不仅增强IL-1β,也促进IL-6与IL-12的分泌。上述结果表明衣康酸通过抑制SDH(而非NRF2或GSDMD)重塑AMs代谢,进而激活促炎反应。
研究进一步探讨了肺泡微环境对AMs免疫代谢特性的关键调控作用,发现AMs离体培养后逐渐丧失对衣康酸的响应性(3天减弱,7天消失),而将BMDMs移植至肺泡5天后,其反应模式由抑炎转为促炎。这表明肺泡微环境能重塑巨噬细胞对衣康酸的应答特性,使其呈现组织特异性反应。
图5.衣康酸的促炎活性不依赖于NRF2和GSDMD介导的信号传导,但与SDH抑制和肺泡微环境相关
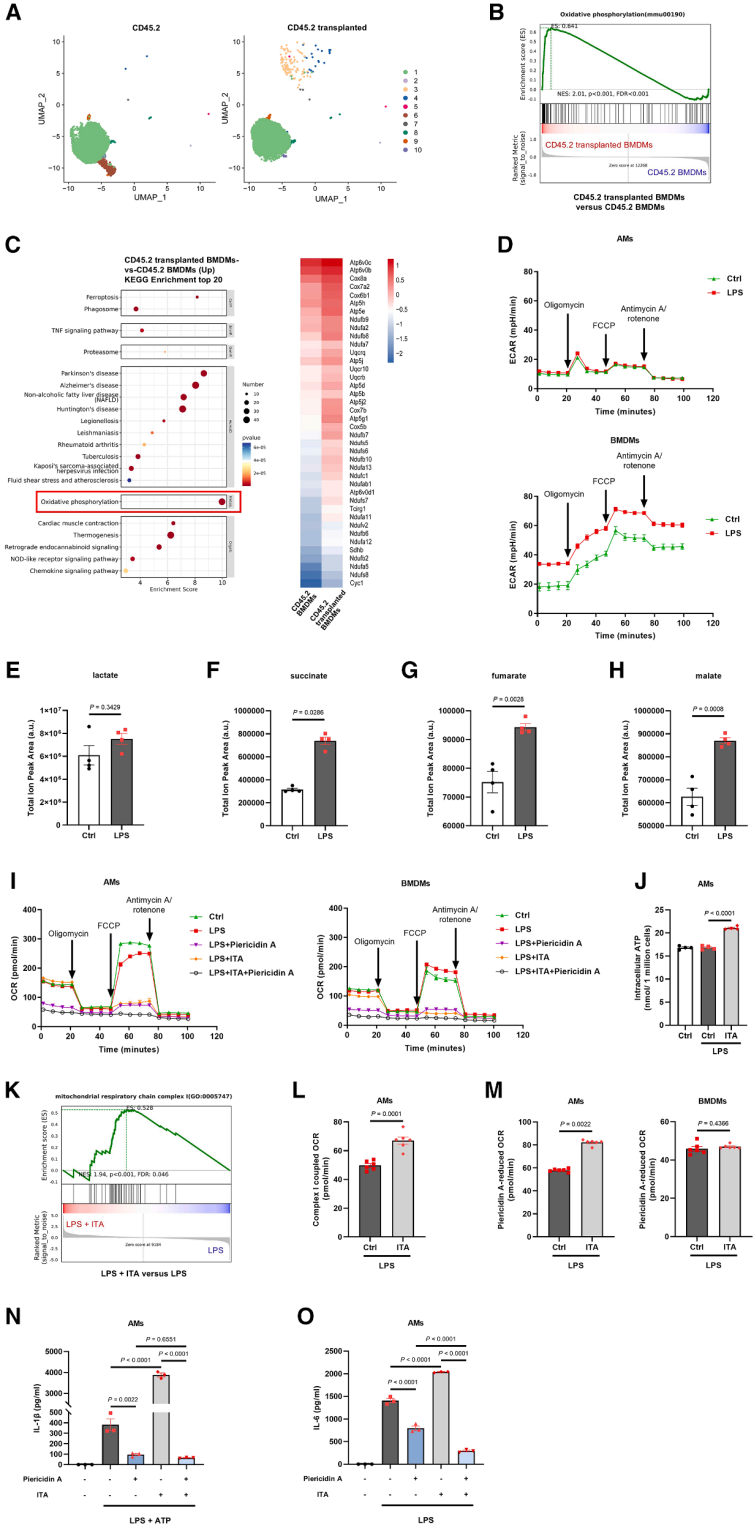
5. 衣康酸通过增强ETC-CI活性促进AMs的炎症反应
通过单细胞测序发现,移植至肺泡的BMDMs显著富集氧化磷酸化(OXPHOS)通路,提示肺泡低葡萄糖微环境驱动巨噬细胞依赖OXPHOS供能。AMs在LPS刺激下仍维持OXPHOS,不转向糖酵解,与BMDMs不同。衣康酸抑制AMs中的琥珀酸脱氢酶(SDH),但AMs通过增强线粒体电子传递链复合物I(ETC-CI)活性代偿,维持耗氧速率(OCR)和ATP生成;而BMDMs因依赖糖酵解,SDH抑制后无法通过ETC-CI代偿,导致能量危机和炎症小体失活。ETC-CI抑制剂PiericidinA可消除衣康酸诱导的AMs中NLRP3炎症小体激活及IL-1β、IL-6等促炎因子释放,证实ETC-CI是衣康酸促炎的关键中介。上述结果表明肺泡微环境塑造的OXPHOS代谢特征,使AMs通过增强ETC-CI活性补偿SDH抑制,进而驱动炎症反应。
图6. 衣康酸通过增强ETC-CI活性促进AMs中NLRP3的活化
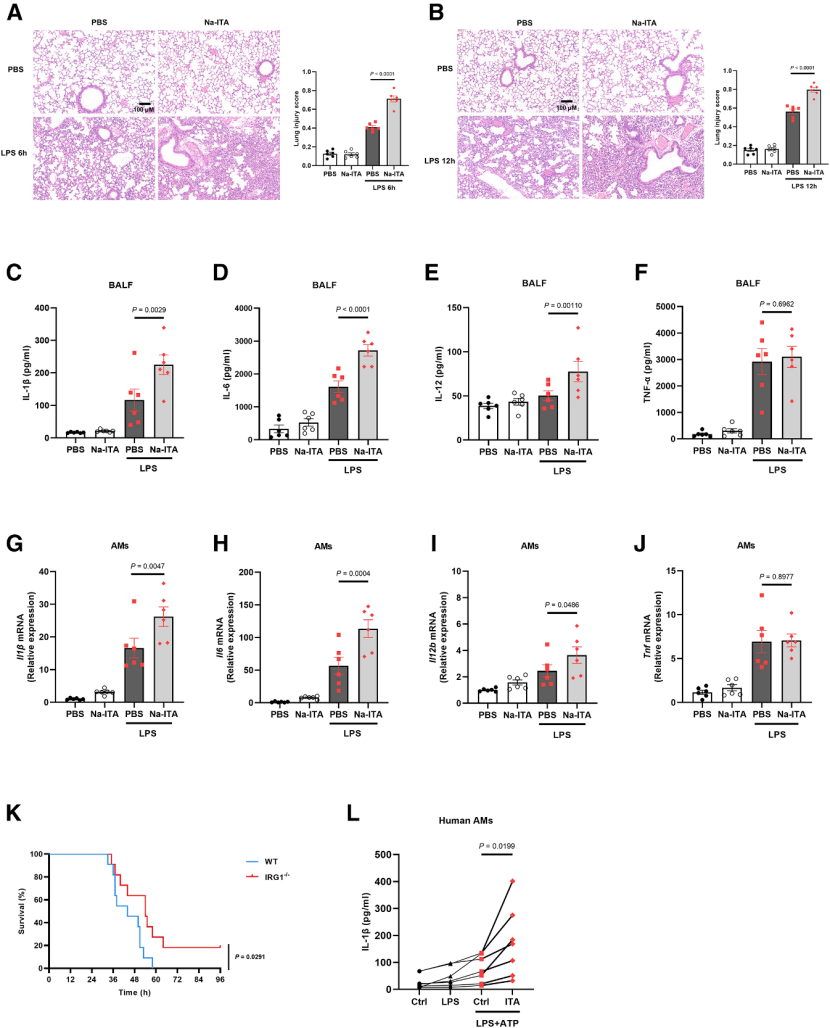
6. 衣康酸加剧急性肺损伤及人源AMs炎症反应的体内外验证
通过小鼠模型发现,气管内滴注2mg/kg衣康酸(pH7.0)预处理可显著加重LPS诱导的急性肺损伤,表现为肺组织病理损伤评分升高、支气管肺泡灌洗液中IL-1β、IL-6和IL-12水平显著升高。体外分离的小鼠AMs中,上述促炎因子mRNA表达同步上调,证实衣康酸在体内增强AMs促炎活性。在人源AMs中,衣康酸可剂量依赖性促进LPS+ATP刺激下成熟IL-1β的释放,且在7名供体中结果一致。
图7. 衣康酸通过促进肺泡巨噬细胞炎症反应加重LPS诱导的急性肺损伤
研究结论
本研究发现衣康酸在AMs中通过促进NLRP3炎症小体活化和ETC-CI依赖的代谢重编程发挥促炎作用,与BMDMs中的抗炎作用相反,揭示了肺泡微环境通过调控巨噬细胞代谢(如OXPHOS偏好)决定其对衣康酸的响应。
参考文献
Itaconate promotes inflammatory responses in tissue-resident alveolar macrophages and exacerbates acute lung injury. Cell Metabolism. 2025
请扫描二维码阅读原文
绘谱帮你测
本文通过[U-13C5]-谷氨酰胺标记示踪,从流量动态变化的角度证实了衣康酸对SDH的抑制作用。麦特绘谱为本研究提供代谢流检测服务,我们的代谢流产品可追踪含13C和15N等被标记物100+种,全面覆盖糖酵解和TCA循环通路、磷酸戊糖途径、 氨基酸代谢、脂肪酸代谢、 一碳代谢、 核苷酸代谢通路等。丰富的个性化标记定制经验–[U-13C6]-Fructose, [U-13C16]-Palmitate, [U-13C3]-Serine, [U-13C2]-Glycine, [U-13C3]-Alanine, [U-13C3]-Pyruvate, [U-13C4]-Malic Acid, [U-13C18]-Oleic Acid, 13CO2, 15N-NH4CL, [1, 2-13C2]-Glucose, [2,3,3-D3]-Serine, [2,3-13C2]-Alanine, [1,2,3-13C3]-Choline等。历经数年项目积累,检测各类贴壁细胞、悬浮细胞、菌体、培养液、线粒体、组织、粪便等样本类型,涵盖多发性骨髓瘤、肝癌、线粒体遗传代谢病、免疫细胞活性与疾病、心血管疾病等多个研究方向,合作项目成果突出,文章平均IF>10+。