降解的RNA可以用于qPCR实验吗?
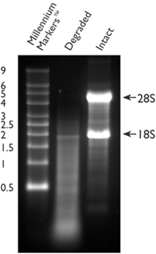
☆在完整的RNA和降解的RNA样本中,检测的基因的Ct值是稳定的吗?
☆如果基因表达差异倍数不大,与RNA降解有关吗?
☆内参基因的作用:降低RNA降解对qPCR的影响
☆引物的选择:扩增合适大小的目的片段
基因定量包含逆转录和定量PCR,获得高纯度、降解程度低的RNA,对于其后的反转、定量结果,自然是非常重要的。
一、RNA完整性(RNA integrity)
RNA的降解程度可根据RIN值来评定,该值由Aligent 2100仪器测定。将RNA完整性分为10级,用数字1、2、3……8、9、10表示。RIN值越接近10,RNA完整性越好;RIN值越接近1,RNA降解越严重。
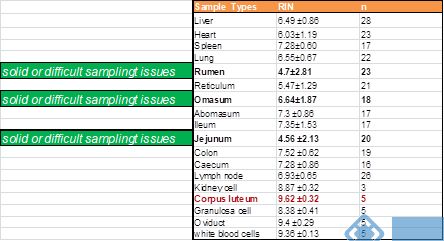
就降解程度而言,来源于组织的RNA较细胞严重。RNA完整性与样本的组成(内源性RNase含量)、保存、处理过程(处理难易程度)、处理时间(处理速度)有关。较坚硬、较难处理的样本(如瘤胃、空肠),获得的RNA的RIN值越小,且不同样本间重复性差。
二、RNA发生降解后,qPCR定量的Ct值变大
Corpus luteum来源的RNA经酶消化处理或紫外线照射,获得不同降解程度的RNA。之后,对18S rRNA、28S rRNA、β-actin及IL-1β定量。
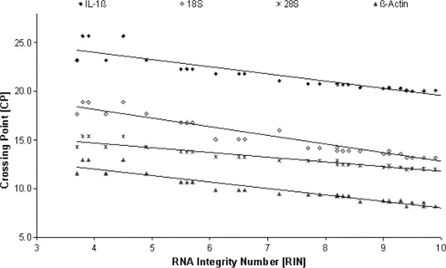
我们可以看到:
1、不论是高丰度表达基因(18S rRNA、28S rRNA、β-actin)或低丰度表达基因(IL-1β),RNA降解程度越高,Ct值越大;RNA完整性越好,Ct值越小。
2、RNA质量越好,Ct值波动越小,qPCR实验的重复性也越好。
三、RNA发生降解后,定量结果不可控
进行基因表达量分析时,可通过选择内参基因尝试消除样本间模板量的差异。RNA的降解可认为是RNA“稳态”的变化,引入内参基因校正样本不同降解程度的差异。那么经内参(β-actin)校正后的基因(18S rRNA、28S rRNA、IL-1β)的qPCR检测结果即△Ct值变化情况如何呢?
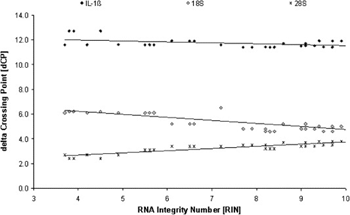
可以看出:1、内参基因(β-actin)校正后,RNA降解前后,△Ct值变化较Ct值变化小。
2、经内参基因校正后,对于一些基因(28S rRNA),RNA降解前后,△Ct值依旧会出现“小的”变化。
因此,RNA模板发生降解,利用相对定量PCR可以定量基因表达的趋势,而进行精确定量需谨慎!因此,基因表达差异倍数不大时,需评估RNA质量。
四、从RNA完整性角度解释:qPCR定量,扩增产物长度最好控制在70-250bp
RNA降解程度与qPCR扩增基因的长度呈现一定的关系:70-250bp,RNA完整性越高,Ct值越小,呈现线性关系。而>400bp,RNA完整性与Ct值之间无明显相关性。因此,RNA模板发生部分降解,对于>400bp以上的目的基因,无法利用相对定量进行定性分析。
RNA发生降解,会影响qPCR的Ct值,导致定量数据的重复性差。即使使用内参基因校正,依旧会造成定量结果出现误差,不能精确反应样本间的基因表达量的差异。但是当降解不严重时,还是可以用于基因的定性分析。
小编码了这么多字,其实就是想说“作为模板的RNA,它的完整性对于做好qPCR实验很有意义”,毕竟RNA是容易降解的。
参考文献
1.Schroeder A; Mueller O; Stocker S; Salowsky R; Leiber M; Gassmann M; Lightfoot S; Menzel W; Granzow M; Ragg T. The RIN: an RNA integrity number for assigning integrity values to RNA measurements[J]. Bmc Molecular Biology, 2006, 7(703):3-3.
2.Fleige S, Walf V, Huch S, et al. Comparison of relative mRNA quantification models and the impact of RNA integrity in quantitative real-time RT-PCR.[J]. Biotechnology Letters, 2006, 28(19):1601-1613.
3.Simone Fleige,Michael W,Pfaffl,et al. RNA integrity and the effect on the real-time qRT-PCR performance[J].Molecular Aspects of Medicine,2006,(27) 126–139.
4.Joëlle V, Katleen D P, Steve L, et al. Measurable impact of RNA quality on gene expression results from quantitative PCR[J]. Nucleic Acids Research, 2011, 39(9):e63-e63.
