
编者按
类器官为肿瘤等疾病的临床前研究或机制研究提供了很好的平台,其作为一个有力的体外模型大大助力了癌症研发及药物筛查,在胆囊癌这一疾病上也不例外,胆囊癌类器官及正常胆囊类器官为胆囊癌的发病以及用药产生了巨大的推力。
今天,我们回顾了一项于2022年12月发表在《Clinicaland Translational Medicine》的经典研究——《Patient-derived organoids for personalized gallbladder cancer modelling and drug screening》,该研究将患者来源的胆囊癌类器官作为了学术研究和个性化医疗的有价值的临床前模型。
一、研究背景
胆囊癌(GBC)是胆道癌中最常见的类型,是第六大最常见的胃肠道恶性肿瘤。手术切除是唯一可以治愈局部GBC患者的方法,但复发率可高达65%,当然也有辅助治疗策略,包括化疗、放疗或联合治疗,然而治疗效果并不令人满意,迫切的需要开发更加个性化和针对性的治疗方法。
类器官是最近开发的三维(3D)培养技术,它表征了原代组织的结构和功能。来源于单个肿瘤患者的患者来源类器官(PDO)可以大量扩增并准确概括原始肿瘤的形态和分子特征。本研究通过使用类器官培养技术,研究人员建立了来源于人正常胆囊、良性胆囊腺瘤(GBA)和GBC组织的类器官。分析了类器官的形态、遗传特征、转录谱和肿瘤内异质性。最后,作者筛选了一系列化合物,以确定可以有效抑制GBC类器官生长的药物。
二、主要研究成果
1、建立源自人正常胆囊、良性GBA和GBC组织的类器官
作者收集了41名未经治疗的GBC患者和5名未经治疗的GBA患者的手术切除肿瘤组织,并成功建立了五个GBC类器官系和两个GBA类器官系。这些类器官扩增至少10代并稳定培养3个月以上。作者将连续维持超过3个月的类器官定义为成功建立。同时,作者从健康的正常胆囊中建立了一种人类正常胆囊类器官,该胆囊表现出单层上皮囊性结构,源自GBA和GBC的类器官表现出不规则形状的囊状筛状结构。在组织学水平上,健康的胆囊衍生类器官培养形成囊状中空结构,类似于正常的胆囊组织。
相比之下,GBA和GBC衍生的类器官显示出不同的组织学和细胞结构,腺体区域和肿瘤细胞以筛状结构生长,与相应的原代组织一致。免疫组化(IHC)和免疫荧光(IF)分析表明,所有类器官及其亲本组织都保留了胆道上皮标志物CK7的表达,这些结果表明,长期培养的胆囊类器官在组织学特征和标志物表达方面密切再现了其原始肿瘤组织 。
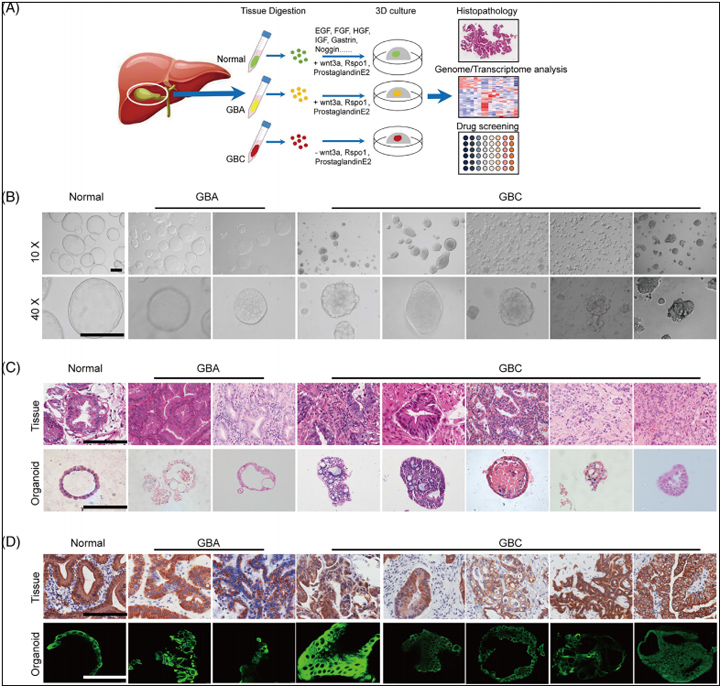
图1 建立源自人正常胆囊、良性GBA和GBC组织的类器官
2、正常胆囊、GBA和GBC类器官保留其原始组织的基因组特征
作者为了确定类器官是否保留其亲本组织的突变特征,对类器官和相应的原代组织进行了全外显子组测序(WES)分析,发现每个类器官保留了其配对原代组织中80%-90%的变异。作者鉴定了癌症相关基因的变异,包括GBC类器官中的TP53、MUC4、MUC16、CTNNA2、TTN、RYR2、MGAT5B、USP29和AKAP6以及GBA类器官中的CTNNA2、CTNNB1、KCNIP3和DSCAML1。这些结果表明,由GBA和GBC产生的类器官概括了在人类胆囊肿瘤中观察到的突变特征和肿瘤特异性突变。

图2 正常胆囊、GBA和GBC类器官保留其原始组织的基因组特征
3、类器官及其原始组织的转录组学分析
作者为了进一步测试类器官,使用RNA测序(RNA-seq)分析,将类器官的基因表达谱与原代组织的基因表达谱进行比较。使用健康的胆囊衍生类器官和原始组织作为对照,基因表达谱的相关分析表明,单个类器官系与其原始组织和肿瘤类型相关。
接下来,对各组间差异表达基因(DEGs)进行基因集富集分析(GSEA),值得注意的是,作者发现了许多信号通路,包括JAK-STAT、mTOR、氧化磷酸化和p53信号通路,它们可以很好地区分正常胆囊、GBA和GBC组织,组织与匹配的类器官之间的轮廓相似。
为了进一步确认类器官系中特定基因及其相应亲本组织中的表达状态,对信号通路中的一组基因进行了分层聚类分析。与之前的数据一致,在GBA和GBC类器官中观察到丝裂原活化蛋白激酶(MAPK)信号传导(RPS6KB1、PIK3R3、MAP3K1、MAP3K2、MAP3K7和CCNE2)、PI3K-AKT-mTOR信号传导(TAB2、PKN2、CREB1),氧化磷酸化途径(COX6B2、ATP6V1C2),Ras信号传导(PDGFC、ELK1和KITLG)和HDAC1、HDAC2、HDAC6中的基因异常和逐渐激活,与原始组织的表达模式非常相似。
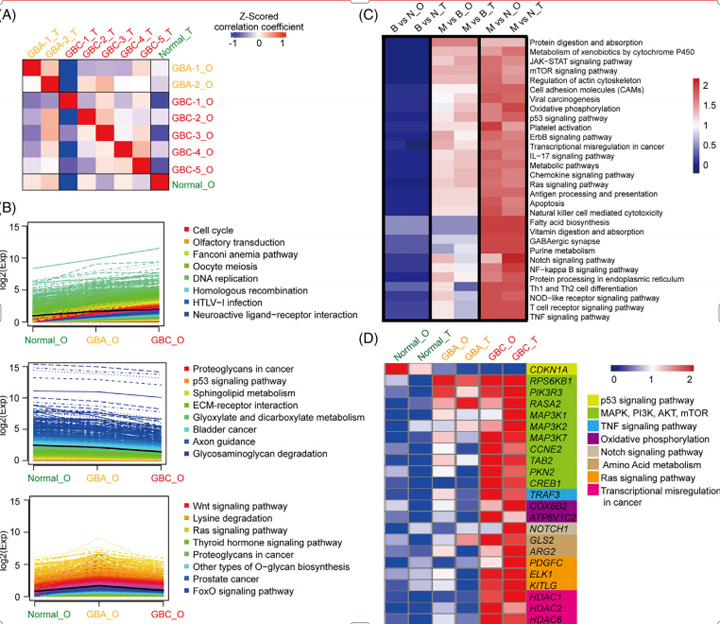
图3 类器官系及其原始组织的转录组学分析
4、类器官及其原始组织的单细胞RNA测序
为了验证类器官的肿瘤内异质性中的可重复性,作者使用三个样本生成了基于液滴的单细胞RNA测序(sc-RNA seq)谱:GBA-2组织(GBA-2_T),GBC-4组织(GBC-4_T)和匹配的GBC-4类器官(GBC-4_O)。经过质量控制和双峰去除,作者总共获得了7124个单细胞。在基因表达标准化后,作者采用UMAP方法来降维。
这些细胞被分配到七个主要的不同细胞类型簇:上皮细胞(EPCAM);间充质细胞(COL1A1和PDGFRB);内皮细胞(PECAM1和CD34);T细胞(CD3E);B细胞(CD79A和MZB1);骨髓细胞(CD14和CD163)和肥大细胞(TPSAB1和KIT)。通过预测大规模染色体CNV,上皮细胞和来自良性GBA-2的染色体畸变存在多种谱,预测CNV要低得多。然而,预测的CNV在GBC-4组织的上皮细胞和匹配的类器官之间高度一致。
总之,这些数据表明GBC衍生的类器官可以在单细胞分辨率下概括其衍生组织的转录特征和异质性。
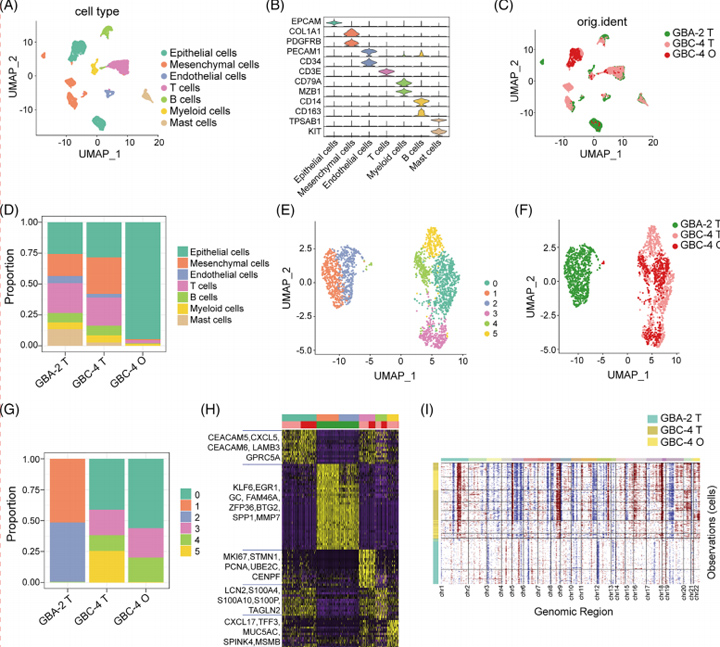
图4 类器官培养物及其原始组织的单细胞RNA测序
5、用于体外患者特异性药物试验的GBC类器官
为了开发更有效的抗GBCs药物,作者选择了29种化合物,靶向肿瘤中常见的信号通路,并评估了它们抑制GBC类器官活力的疗效。作者首先研究了这些抑制剂对正常胆囊类器官的毒性,九种化合物(例如地兰佐米、曲美替尼和普西诺他)对正常类器官有显著的抑制作用。作者进一步应用剩余的20种化合物来检查GBC类器官的药物反应。
应该注意的是,不同的GBC类器官表现出不同的药物反应,所有这些GBC类器官对靶向JAK、PI3K、MAPK、RAF、PARP、AMPK和Hedgehog的各种抑制剂具有广泛的耐药性。伏立诺他和姜黄素——HDAC抑制剂,有效地抑制了GBC类器官的生长,此外,类器官系中不同剂量的伏立诺他治疗以剂量依赖性方式证明了对GBC类器官的抑制作用,IC50从1.11到18.05 μM,表明HDAC抑制剂是对抗GBC类器官的潜在药物。
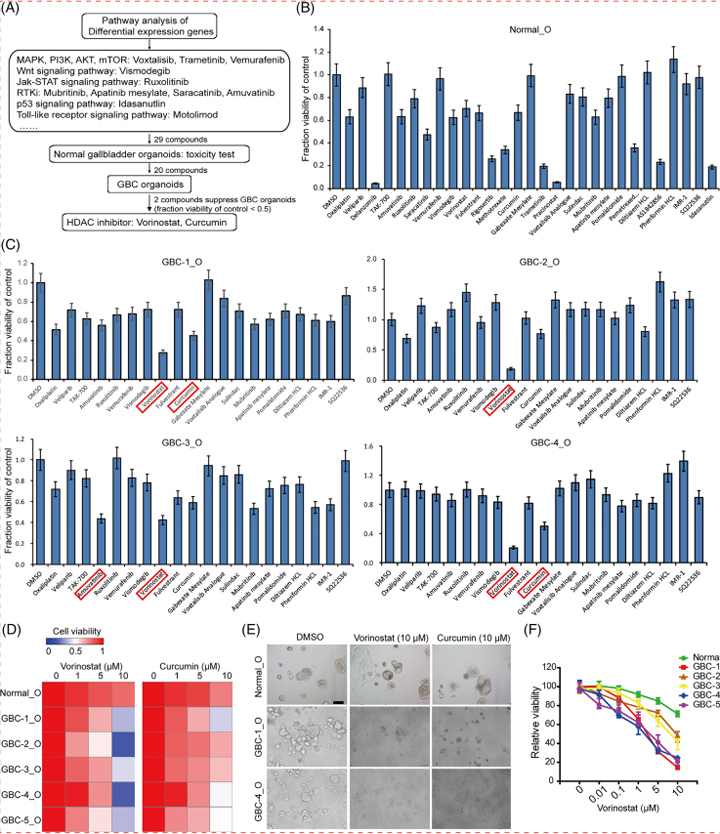
图5 胆囊癌 (GBC) 类器官用于体外药物筛选
6、GBC组织中HDAC1、-2和-6的过表达预示预后不良
为了探讨HDACs在GBC中表达的临床意义,作者在人GBC(100个样本)和正常胆囊(10个样本)组织中进行了IHC染色。与正常胆囊组织相比,GBC组织中HDAC1,-2和-6的表达水平明显上调。根据HDAC1、-2和-6在肿瘤组织中表达的IHC结果,将所有100个GBC样品分为低表达组和高表达组。统计分析显示, HDAC1高表达组的淋巴结状态较差(P=0.003)和肿瘤淋巴结转移(TNM)分期为晚期(P = 0.01);HDAC2高表达组肝脏浸润患者较多(P = 0.03)。这些发现证明HDAC1、-2和-6是GBC预后不良的预测因子,这进一步表明了HDAC抑制剂的治疗价值。
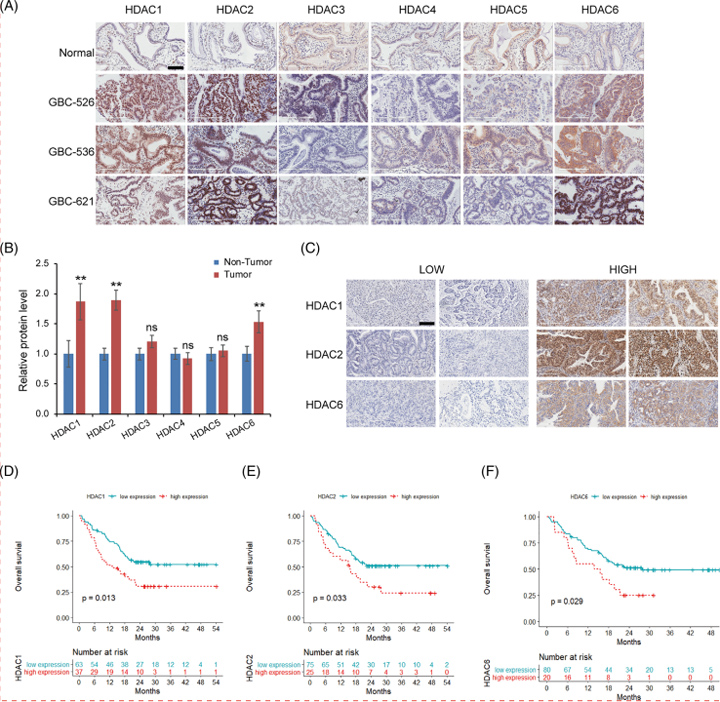
图6 GBC中组蛋白去乙酰化酶(HDAC1)、-2和-6的上调与预后不良
共抑制HDAC和其他促肿瘤信号通路协同抑制GBC类器官生长
鉴于HDACs和GBC中其他促肿瘤信号通路(如PI3K-AKT和Ras信号传导)的共同共激活,作者旨在确定这些通路与HDAC的联合抑制是否对GBC患者具有协同抗肿瘤作用。此外,在GBC类器官衍生的异种移植模型中,伏立诺他或CUDC-907治疗均造成了肿瘤生长抑制,并且正如预期的那样,PI3K-HDAC双重抑制剂CUDC-907表现出比伏立诺他更强的抗肿瘤活性。
这些结果表明,抑制促肿瘤信号通路和HDAC可能是GBC患者的可行治疗策略。
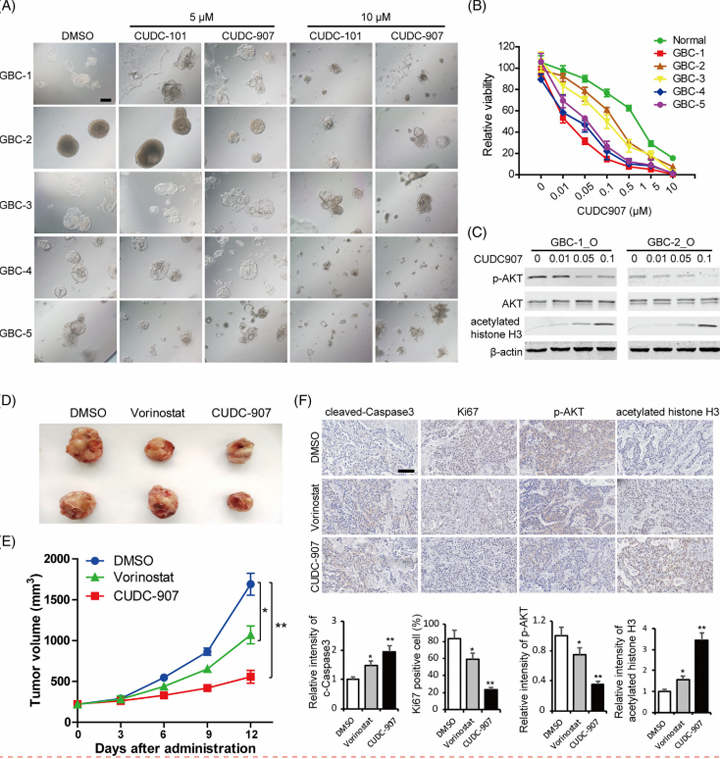
图7 共抑制HDAC和其他促肿瘤信号通路协同抑制GBC类器官生长
三、编者点评
作者通过测试GBC类器官对每个生态因子的依赖性,优化了GBC类器官培养基的组成,从而大大降低了研发成本。为了评估GBC类器官作为精准医学工具的价值,作者通过H&E染色、免疫组织化学和免疫荧光鉴定类器官培养物的组织病理学特征,通过全外显子组测序和RNA测序分析类器官的遗传和转录特征,筛选了一组靶向GBC中最活跃信号通路的化合物。综上所述,GBC类器官保留了其原有肿瘤组织的特征,可推进GBC的基础研究,促进精准医学的发展!
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务CRO、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已建立胆囊癌及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020.CA Cancer J Clin. 2020;70:7-30
[2]Recio-Boiles A, Kashyap S, Babiker HM. Gallbladder Cancer. StatPearls; 2021.
[3]Wernberg JA, Lucarelli DD. Gallbladder cancer. Surg Clin North Am. 2014;94:343-360.
[4]Falzone L, Salomone S, Libra M. Evolution of cancer pharmacological treatments at the turn of the third millennium. Front Pharmacol. 2018;9:1300.
[5]Oneda E, Abu Hilal M, Zaniboni A. Biliary tract cancer: current medical treatment strategies. Cancers (Basel). 2020;12:1237
[6]Sutherland M, Ahmed O, Zaidi A, Ahmed S. Current progress in systemic therapy for biliary tract cancers.J Hepatobiliary Pancreat Sci. 2021.00:1–14
[7]MKim J, Koo BK, Knoblich JA. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 2020;21:571-584.
