
腺相关病毒(adeno-associated virus, AAV)是微小病毒科(Parvoviridae)家族的成员之一,是一类无法自主复制、无被膜的二十面体微小病毒,其直径约20-26nm,含有4.7kb左右的线状单链DNA作为基因组。研究中采用的重组腺相关病毒载体(Recombination adeno-associated virus, rAAV)是在非致病的野生型AAV基础上改造而成的基因载体,由于其种类多样、免疫原性极低、安全性高、宿主细胞范围广(对分裂细胞和非分裂细胞均具有感染能力)、扩散能力强、体内表达基因时间长等,rAAV被视为最有前途的基因研究和基因治疗载体之一。
下面就AAV血清型选择、病毒注射技术及用量等方面来分享,请跟随我们的脚步走起。
01 AAV血清型选择
AAV血清型多样,其进入细胞主要依赖于受体介导的内吞作用,不同血清型衣壳表面的特定结构位点与宿主细胞表面受体、共受体、及细胞内的泛素化等相互作用,决定了各自受体的特异性。
AAV2是最早被克隆的病毒,也是迄今研究最为彻底、应用最为广泛的病毒载体。现在研究中常用的rAAV就是利用AAV2型基因组与不同的衣壳蛋白结合产生的混合体病毒载体,一般标记为rAAV2/N (N为不同的衣壳血清型)。重组的病毒具有AAV2型的稳定表达和基因整合能力,同时获得了不同血清型的组织感染嗜亲性,表现出一定的器官靶向特异性。
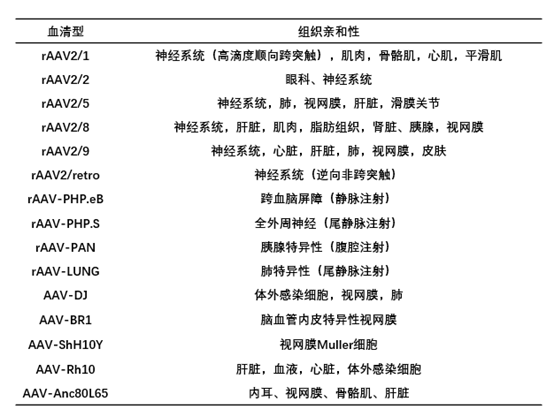
在动物研究过程中,如果无法确定血清型的选择,可以尝试和元生物的Pandora’s Virus (rAAV试用装)进行预实验,通过比较不同血清型对目标组织的感染效果,摸索最佳实验条件(注射方法、注射位点、病毒用量等),解决病毒载体选择的烦恼,得到更理想的实验结果。
02 病毒注射技术及注射量
动物疾病模型是具有人类疾病模拟性表现的实验对象和材料,它是探索人类疾病本质及新药有效性评价的一个重要方法和手段。
在我们进行动物疾病模型构建的基础研究过程中,往往需要借助注射技术,将药物、病毒载体、荧光染料等注射到动物体内,以构建动物模型,亦或是研究其作用机制及代谢途径等,来观察疾病发生发展规律,研究防治措施。
下面就与大家分享几种常用的动物注射技术。
尾静脉注射技术
尾静脉注射因其操作技术简单,是最常见的一种动物注射技术手段之一。通过尾静脉注射,将一定滴度和体积的rAAV病毒载体注射到动物体内,目的基因将得以表达。

操作步骤
1.使用小鼠固定器,酒精棉擦拭小鼠尾部,尾静脉肉眼清晰可见。
2.距尾尖1/3处小于30度角度进针后见回血,立即注射。
3.如无阻力,表示针头已进入静脉,可继续注入。
4.注射完毕后,用干棉球按压伤口3-5min。
注意事项
1.进针深度为针头2/3。
2.注射时如遇阻力,出现白色皮丘,需要在上方1cm处再次注射。
3.平缓注射,不可注射含有空气的液体。
4.循环途径:直接进入血液循环。
5.参考给药量:0.005-0.01ml/g(小鼠)。
和元生物尾静脉注射感染组织脏器实例

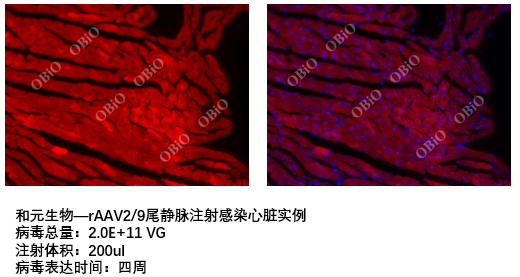

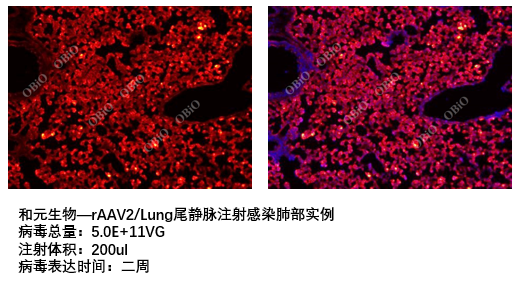
局部定点注射技术
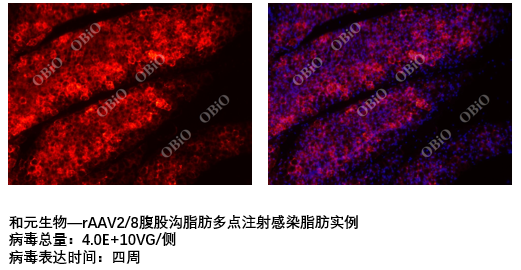
脂肪注射操作步骤
1.用5%的水合氯醛将动物麻醉,去除腹部的腹股沟处毛发,并用75%酒精擦拭消毒。
2.在腹股沟处,用眼科镊将腹股沟处的皮肤轻轻提起,用胰岛素针从提起的皮肤与腹部之间处入针,进针方向为沿着腹部进针。
3.固定注射器位置,轻轻推入。
4.将注射器缓缓抽出。
和元生物—rAAV2/8腹股沟脂肪多点注射感染脂肪实例
肌肉注射操作步骤
1.抓取小鼠,使其注射部位正对实验人员。
2.将针头垂直迅速刺入外侧肌肉。
3.回抽针栓如无回血,将药物注入。
4.注射完毕后,用干棉球按压伤口3-5min。
注意事项
1.防止刺伤肠道、膀胱或其它内脏器官。
2.腹腔注射宜用等渗药液,不宜刺激性药液
3.循环途径:肠系膜上静脉→肝门静脉→肝→肝静脉→下腔静脉→进入血液循环
4.参考给药量:0.01-0.02ml/g(小鼠)
和元生物—rAAV2/8后腿肌肉多点注射感染肌肉实例

腹腔注射操作步骤
1.抓取小鼠,使其腹部朝上头部略向下垂。
2.抓紧背部皮肤使腹部皮肤紧绷,于腹腔下边缘位置(左/右侧)进针。
3.针头沿皮下向前推进2-3cm,针头与皮肤呈45°角刺入腹膜。
4.回抽无回流物,缓慢推入药物
注意事项
1.进针深度为针头2/3,肌肉注射的时候倾斜30度角注射。
2.一般选肌肉发达,无大血管通过的部位,多选臀及大腿部位。
3.药物水溶液吸收十分迅速,适用于油溶液和某些刺激性物质。
4.循环途径:直接进入血液循环。
5.参考给药量:50~100ul(小鼠)
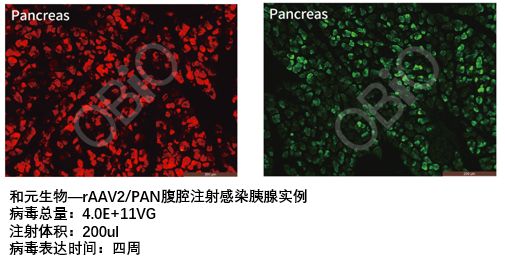
和元生物—rAAV2/PAN腹腔注射感染胰腺实例
业务咨询

病毒相关技术服务
