注: PE 和 APC 的完整操作步骤及标记方案在最后两页,如果不需要看介绍,可直接跳过
藻 红 蛋 白 (R-PE 及 B-PE)
特 点 :
1.从红藻中纯化
2.具有极高的发射量子产率
3.荧光团与蛋白质主链共价结合,不被淬灭
4.高水溶性
R-PE 与 B-PE 的 区 别 :
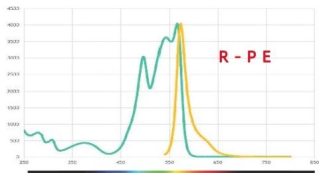
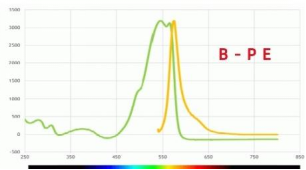
Wavelength (nm) Wavelerngn (mm)
R-PE 与 B-PE 的 对 比 :
|
|
R-PE |
B-PE |
|
分子量 |
240,000 |
240,000 |
|
最大吸收 |
565 nm |
545 nm |
|
额外的吸收峰 |
498 nm |
564nm |
|
最大发射 |
573 nm |
573 nm |
|
消光系数(ε) |
1.96x106 M-1cm-1 |
2.41x106 M-1cm-1 |
|
荧光量子产率(QY) |
0.84 |
0.98 |
|
吸收比 |
A566/A280≥5.0 A566/A498<1.5 A620/A566<0.01 |
A545/A280≥5.5 A565/A496<2.7 A620/A545<0.01 |
1.特 点 :
1.从蓝藻中纯化
2.具有极高的发射量子产率
3.荧光团与蛋白质主链共价结合,不被淬灭
4.高水溶性
APC 和 C-PC 的区别:
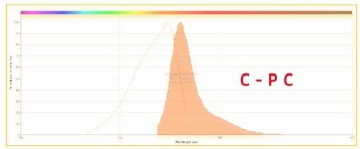

APC 和 C-PC 的对比:
|
|
APC |
C-PC |
|
分子量 |
104,000 |
264,000 |
|
最大吸收 |
651nm |
651nm |
|
最大发射 |
662nm |
647 nm |
|
消光系数(ɛ) |
7.3x105 M-1cm-1 |
1.53x106cm-1M-1 |
|
荧光量子产率(QY) |
0.68 |
0.81 |
|
吸收比 |
A650/A620≥1.25 A650/A280≥4.5 |
A652/A620<0.3 A620/A280>4 |
交 联 APC 和 APC 的 对 比 :
1.APC 结构: 它具有α和β亚基,具有明显的(αβ)3 四级结构。
2.为什么要将APC 进 行 交 联 ? 答 :交联是为了防止APC 在稀释或暴露于变性盐(如尿素或盐酸胍) 时
发生可逆解离,从而保持其结构和功能稳定。
3. 如何进行 APC 交联?
答:通过α和β亚基间的特异性交联可以阻止APC 的分解。
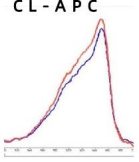
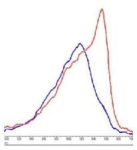 交联比:>1.0
交联比:>1.0
|
|
NaClO4 |
A650:A620 |
|
CL-APC |
|
1.465849387 |
|
CL-APC+NaClO4 |
+ |
1.386850153/ |
|
|
NaClO4 |
A650:A620 |
|
APC |
|
1.587272727 |
|
APC+NaClO4 |
+ |
0.317901235 |
注:图中的红色线条为没有添加NaClO4, 蓝色线条为添加了NaClO4。
如图及表中信息所示, CL-APC 图中添加NaClO4 及没添加NaClO4, 吸收比没有明显变化。而在未交联的APC
中, 添加NaClO4, 得到的吸收比有非常大的变化, 因为APC中加入了NaClO4 导致了它出现了解离。
2.
特 点 :
1.存在于大多数光合作用的甲藻中
2.高水溶性
3.大斯托克斯位移
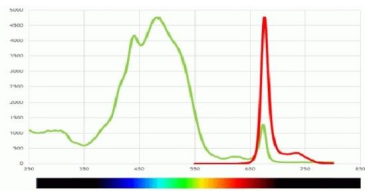
光 谱 特 性 :
|
|
PerCP |
|
分子量 |
35,000 |
|
最大吸收 |
483nm |
|
最大发射 |
676nm |
|
消光系数(ε) |
4.0x105 M-1cm-1 |
|
荧光量子产率(QY) |
1.0 |
|
亮度(exQY) |
4.9x105M-1cm-1 |
|
吸收比 |
A482/A280>4.0 |
优 点 :
1.高量子产率
2.高水溶性
3.大量结合位点
4.匹配流式细胞仪
5.大斯托克斯位移
6.制备串联染料的良好供体
优 点 :
1.高量子产率
2.高水溶性
3.大量结合位点
4.匹配流式细胞仪
5.大斯托克斯位移
6.制备串联染料的良好供体
4.
注1:整个缀合过程可以在一天内完成。但是,缀合前对 PE 的纯化可能需要24-48小时。除了下面列 出的材料外,您还需要浓度至少为 2 mg/ml 的抗体溶液。请您在进行PE 抗体缀合实验之前熟悉如
何使用脱盐柱以及如何获取吸光度光谱。
注 2 : SMCC-PE 缀合物非常稳定 (在“交换缓冲液”中,在4C 下至少可以稳定几个月)。因此, 如果您需要节省一部分时间,可以选择同时缀合10 毫克或更多的 PE, 并将其用于几次抗体实验(在
几周内)。 SMCC-PE 的长期储存最好是作为饱和硫酸铵沉淀物。
一 .P E 的 制 备
1.将 PE 纯化。缀合前的浓度通常为 5-10 mg/ml 。 注意: PE 在缀合前作为 SAS ( 硫 酸 铵 钠 ) 沉
淀物最稳定。如果将 PE 以 SAS 沉淀物的形式储存,则必须在使用前进行大量纯化。
2.使用3 .5毫克R-PE 修饰每毫克lgG, 包括在缓冲液交换过程中损失的额外10%。
3. 检查 PE 的纯度和浓度,请测量280、565 和 6 2 0 nm 处的吸光度。 (1 mg/ml 的 PE 在 565nm 处的 OD 为 8 . 2 ) 。 5 6 5 / 6 2 0 比 率 > 5 0 表示已充分去除污染的藻蓝蛋白;565/280 比 率 > 5 表示已充分去除所有其他蛋白质。
二 .P E 的 活 化
1.使用前在无水 DMSO 中制备 10 mg/ml 的 SMCC 储备溶液。
2.每毫克 PE 加 入 1 1 μlSMCC, 并进行涡旋。将反应管用铝箔包好,室温下旋转60 分钟。
3.将纯化的 PE 过凝胶过滤柱来交换缓冲液。
注意:对于失败或效果较差的结合,增加或减少 SMCC 相对于 PE 的量,可能会有所好转。
三 . 1gG 还 原
1.在蒸馏水中制备 1 M DTT(15.4 mg/100 μl) 的新鲜溶液。
2.1gG 溶液浓度应为 4 mg/ml 或更高,这样效果比较好。还原几乎可以在任何缓冲液中进行; MES 、 磷酸盐和 TRIS 缓冲液 (pH 范围为 6 至8)已被验证可以使用。如果抗体浓度低于 2 mg/ml, 则应浓缩。缓冲液交换柱上的损失应额外增加10%。
3.用 DTT 配制 20 mMlgG 溶液:每毫升 IgG 溶液加入 20μ lDTT 原液并搅拌。室温下静置30
分钟,无需额外搅拌 (以尽量减少半胱氨酸再氧化为胱氨酸)。
4.将还原的lgG 通过预平衡的“交换缓冲液”过滤柱。收集0.25毫升的级分,测定蛋白浓度,并将含
有大部分lgG 的级分汇集在一起。可以通过分光光度法或比色法完成。
5.此步骤后尽快进行缀合。
注意:对于结合较差或失败的情况,降低 DTT 浓度可能会有所帮助。
四 .进 行 缀 合
1.每毫克 IgG 添 加 3.2 毫克 SMCC-PE。 用铝箔包裹反应管并在室温下旋转60 分钟。注意:这些
摩 尔 比 ( 每 IgG 约 2 个 PE) 效果很好。对于失败或效果不佳的结合,不同的摩尔比可能会有所帮 助。
2.60 分钟后,必须去掉 lgG 上未反应的游离巯基。
3.在 1.0 ml 干 DMSO 中制备 10 mg NEM 的新鲜溶液。
4.每 毫 克 |gG 添加 34μ g(3.4μl) 。 室温下包裹并旋转20 分钟。
1.
2.60 分钟后,必须去掉 lgG 上未反应的游离巯基。
3.在 1.0 ml 干 DMSO 中制备 10 mg NEM 的新鲜溶液。
4.每毫克 |gG 添加 34μ g(3.4μl) 。 室温下包裹并旋转20 分钟。
2.
注1:整个缀合过程可以在 一天内完成。但是,缀合前对APC 的纯化可能需要24-48小时。除了下面
列出的材料外,您还需要浓度至少为 2 mg/ml 的抗体溶液。请您在进行APC 抗体缀合实验之前熟悉
如何使用脱盐柱以及如何获取吸光度光谱。
注 2 : SMCC-APC 缀合物非常稳定(在“交换缓冲液”中,在4C 下至少可以稳定几个月)。因此, 如果您需要节省一部分时间,可以选择同时缀合10 毫克或更多的 APC, 并将其用于几次抗体实验(
在几周内)。 SMCC-APC 的长期储存最好是作为饱和硫酸铵沉淀物。
一 .A PC 的 制 备
1.将 APC 纯化。缀合前的浓度通常为 5-10 mg/ml 。 注意: APC 在缀合前作为 SAS (硫酸铵钠)
沉淀物最稳定。如果将 APC 以 SAS 沉淀物的形式储存,则必须在使用前进行大量纯化。在用每毫 升 1 升的“透析缓冲液”透析之前,用每毫升1 升 APC 的 PBS 进行透析2 次。
2.使用1 .7毫克APC 修饰每毫克lgG, 包括在缓冲液交换过程中损失的额外10%。
3.检查 APC 的纯度和浓度,请测量280、620和655 nm 处的吸光度。 (1 mg/ml 的 APC 在 655nm 处的 OD 为 5 . 9 ) 。 655/620 比 率 > 1 . 4 表明杂质被充分去除; 655/280 比 率 > 4 表 明所有其他蛋白质均已充分去除
二 .A PC 的 活 化
1.使用前在无水 DMSO 中制备 10 mg/ml 的 SMCC 储备溶液。
2.每毫克 APC 加 入 6 μlSMCC, 并进行涡旋。将反应管用铝箔包好,室温下旋转60 分钟。
3.将纯化的 APC 过凝胶过滤柱来交换缓冲液。
注意:对于失败或效果较差的结合,增加或减少 SMCC 相对于 APC 的量,可能会有所好转。
三 . 1gG 还 原
1.在蒸馏水中制备 1 M DTT(15.4 mg/100 μl) 的新鲜溶液。
2.1gG 溶液浓度应为 4 mg/ml 或更高,这样效果比较好。还原几乎可以在任何缓冲液中进行; MES 、 磷酸盐和 TRIS 缓冲液 (pH 范围为 6 至8)已被验证可以使用。如果抗体浓度低于 2 mg/ml, 则应浓缩。缓冲液交换柱上的损失应额外增加10%。
3.用 DTT 配制 20 mMlgG 溶液:每毫升 IgG 溶液加入 20μ lDTT 原液并搅拌。室温下静置30
分钟,无需额外搅拌 (以尽量减少半胱氨酸再氧化为胱氨酸)。
4.将还原的lgG 通过预平衡的“交换缓冲液”过滤柱。收集0.25毫升的级分,测定蛋白浓度,并将含
有大部分lgG 的级分汇集在一起。可以通过分光光度法或比色法完成。
5.此步骤后尽快进行缀合。
注意:对于结合较差或失败的情况,降低 DTT 浓度可能会有所帮助。
四 .进 行 缀 合
1.每毫克IgG 添加 1 . 5毫克 SMCC-APC 。 用铝箔包裹反应管并在室温下旋转60 分钟。注意:这 些 摩 尔 比 ( 每 1gG 约 2 个 APC) 效果很好。对于失败或效果不佳的结合,不同的摩尔比可能会有所 帮助。
2.60 分钟后,必须去掉 lgG 上未反应的游离巯基。
3.在 1.0 ml 干 DMSO 中制备 10 mg NEM 的新鲜溶液。
4.每 毫 克 |gG 添加 34μ g(3.4μl) 。 室温下包裹并旋转20 分钟。
2.60 分钟后,必须去掉 lgG 上未反应的游离巯基。
3.在 1.0 ml 干 DMSO 中制备 10 mg NEM 的新鲜溶液。
4.每毫克 |gG 添加 34μ g(3.4μl) 。 室温下包裹并旋转20 分钟。
