
期刊:Frontiers in cell and developmental biology
影响因子:5.5
关键技术:单细胞测序
导语
缺氧是肿瘤微环境(TME)的一个特征,是肿瘤进展的主要因素。然而,在单细胞分辨率下肿瘤相关非癌细胞的亚型鉴定,以及它们如何在缺氧TME下影响癌症进展,在很大程度上尚未探索。在此,我们使用来自108名患者的424194个单细胞的RNA-seq数据来识别癌症细胞、基质细胞和免疫细胞的亚型;评估他们的缺氧评分;以及揭示这些细胞在体内六种癌症类型之间的潜在相互作用信号。我们通过旁分泌模式与癌症细胞相互作用,确定了SPP1+肿瘤相关巨噬细胞(TAM)亚群可能增强上皮-间质转化(EMT)。我们优先将SPP1作为TAM分泌因子作用于癌症细胞,并发现重组蛋白SPP1诱导的A549癌症细胞的迁移表型和侵袭能力显著增强。此外,预后分析表明,在6种癌症类型中,SPP1的高表达与较差的临床结果有关。基于单细胞数据,缺氧高巨噬细胞中的SPP1表达更高,这进一步得到了体外实验的验证,即与常氧条件相比,缺氧培养的巨噬细胞中SPP1的表达上调。此外,差异分析表明,缺氧可能影响各种癌症类型的细胞外基质重塑、糖酵解和白细胞介素-10信号激活。我们的工作阐明了缺氧TME中不同细胞亚型之间复杂相互作用的更清晰的潜在机制,并提出了专门针对缺氧病变中SPP1+TAM比例高的患者开发治疗靶点的指导方针。
技术服务
单细胞测序
研究结果
1. scRNA-Seq分析揭示六种癌症类型的细胞格局
经过严格的质量控制(QC)和过滤,我们收集了25318、15347、6019、14991和21447个来自正常组织的单细胞;CRC、LC、OV、PDAC和SCC中分别有57486、32509、17732、40940和25772个肿瘤衍生细胞;不列颠哥伦比亚省有24160个肿瘤衍生细胞。我们将每种癌症类型的所有细胞分为6-10个主要簇,并确定上皮细胞、基质细胞(成纤维细胞、周细胞和内皮细胞)和免疫细胞(T/NK细胞、B/浆细胞、髓细胞和肥大细胞)为主要细胞类型(图1)。我们观察到癌症类型中每种细胞类型的细胞比例不同。T/NK细胞在SCC中仅为4%,在PDAC中为7%,在OV中为10%,而在CRC中为32%,在LC中为42%,在BC中为45%(补充图1A和补充表1)。此外,每位患者的细胞比例也有所不同,表明肿瘤间存在异质性(补充图1B)。
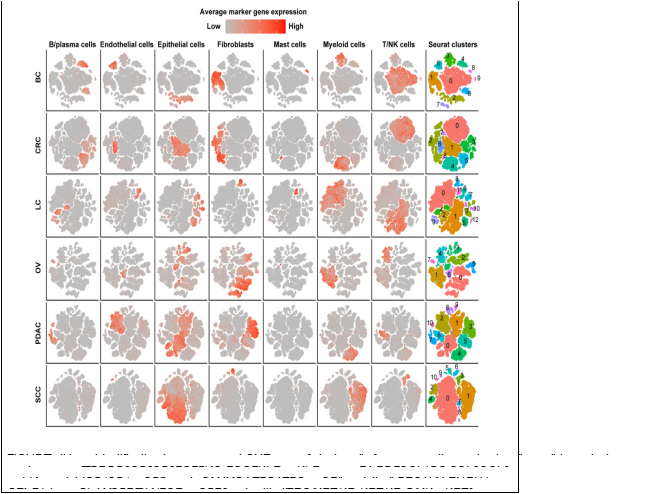
2. 基质细胞、髓系细胞和T细胞亚型的缺氧评分
为了评估TME中这些主要细胞类型的缺氧水平,我们对来自癌症组织的细胞进行了亚聚类分析,并计算了癌症类型中每个亚型的缺氧评分。基质细胞的亚簇主要分为三大类:周细胞、肌成纤维细胞和成纤维细胞(补充图2A)。由于SCC中几乎没有成纤维细胞(710个细胞),我们未能对该癌症中的基质细胞进行亚分类,而对基质细胞的其余研究集中于其他五种癌症类型。我们以标记的形式按顺序命名成纤维细胞簇(例如,FS1和FS2分别是簇0和1)。根据先前研究的标志物(Costa et al.,2018;Kieffer et al.,2020)和每个簇中显著上调的基因,我们将成纤维细胞称为特定癌症类型中的胶原蛋白相关CAF、趋化因子相关CAF和白细胞介素(IL)信号相关CAF。白细胞介素信号相关CAF[BC中的FS5(簇4)]上调了炎症特征,如BC中的干扰素反应和炎症反应(图2A)。六种癌症类型的胶原相关CAF[FS1(簇0)]表现出最高的细胞外基质(ECM)重塑得分(补充图2B)。然而,癌症类型的CAF缺氧评分没有一致的趋势。
从两个方面对髓样细胞进行了研究,包括亚型鉴定和炎症特征评估。使用常规标记基因,我们鉴定了树突状细胞、单核细胞和巨噬细胞,并发现了所有癌症类型的共同亚群(补充图2C)。我们根据先前研究中引用的标记物/基因集区分了促炎和抗炎单核细胞/巨噬细胞(Azizi等人,2018;图2B和补充图3A)。然而,一些特定的TAM具有混合表型,表达促炎和抗炎特征以及M1和M2基因特征(图2B和补充图2C、3A),与之前的研究一致(Lee等人,2020)。值得注意的现象是,SPP1在一个亚型中表达较高,如BC中的M-S1(簇0);CRC中的M-S3(簇2);LC中的M-S1(簇0)和M-S2(簇1);OV中的M-S1(簇0)和M-S5(簇4);PDAC中的M-S2(簇1);以及SCC中的M-S3(簇2),其在六种癌症类型中普遍存在(图2B和补充表2)。我们将这些亚型命名为SPP1+TAM,发现与ECM重塑相关的基质金属肽酶9(MMP9)也在SPP1+TAMs中高度表达(图2B)。值得注意的是,与其他亚型相比,SPP1+TAM的缺氧评分更高(图2B)。鉴于SPP1+TAM的上述特征,它们可能在缺氧TME的影响下在肿瘤进展中发挥核心作用。
T/NK细胞的亚群导致CD4+T细胞、CD8+T细胞和NK细胞的鉴定(补充图3C)。我们打算通过关键抑制性受体(PDCD1、TIGIT、HAVCR2、LAG3和CTLA4)的基因表达来鉴定CD8+T细胞的耗竭状态(补充图3C)。然而,表达耗竭基因的细胞在CD8+T细胞中也高度表达细胞毒性标志物(GZMB和IFNG),这进一步证实了一个特定的亚群高度表现出细胞毒性评分和耗竭评分(补充图3D)。如补充图3D所示,与其他簇相比,CRC中的CD8-S3(簇4)表现出更高的细胞毒性和耗竭评分。这一观察结果似乎是一个与之前的scRNA-seq研究类似的激活依赖性耗竭表达程序(Guo等人,2018)。出乎意料的是,耗尽的CD4+T细胞[CD4-S5(簇4)在BC;CD4-S9(簇8)在CRC;CD4-S6(簇5)在LC;CD4-S4(簇3)在PDAC;和CD4-S4在SCC]在五种癌症类型中被区分。由于之前的一项研究(Scharping等人,2021)表明T细胞耗竭是在缺氧环境下驱动的,因此有人认为缺氧和耗竭之间可能存在关联。然后,我们进行了相关性分析,发现缺氧评分与六种癌症类型T细胞的衰竭评分高度相关,但与细胞毒性评分无关(图2D)。
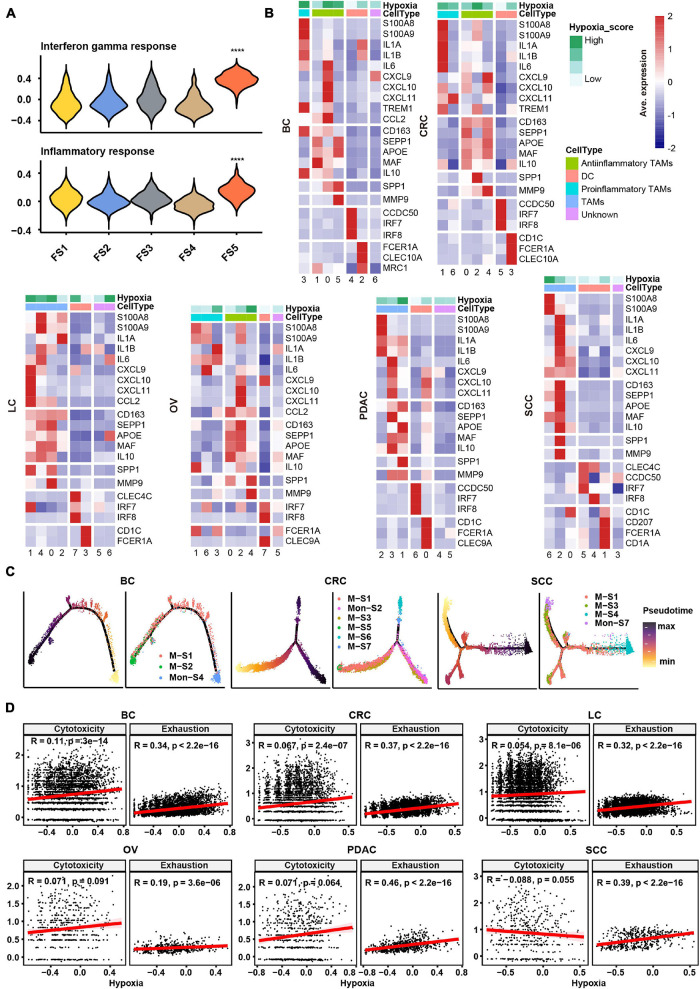
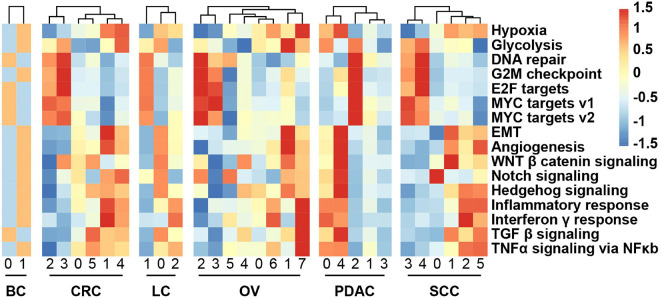
3. 恶性细胞的转录异质性及其与缺氧的关系
我们获得了恶性上皮细胞亚群和每个亚群的DEGs。接下来,我们探讨了同一癌症类型中不同癌症细胞的表达状态如何变化,并应用了反映癌症相关标志性途径活性的GSVA。一些亚群的GSVA分布显示,与上皮间质转化(EMT)和血管生成相关的基因显著富集,而一些亚群在细胞周期相关的标志物中高度富集:E2F/MYC靶点和G2M检查点,表明肿瘤内异质性(图3)。值得注意的是,观察到高缺氧亚群与EMT程序亚群相同。妊娠早期STB中的亚型特异性增强子-基因调控网络
4. 骨髓基质细胞与癌症细胞的串扰
为了破译细胞间相互作用的分子关联,我们使用潜在的配体-受体(L-R)对相互作用构建了不同细胞亚型之间的细胞通讯网络(补充图4A和补充表5)。重要的是,癌症细胞和髓细胞之间的相互作用数量被预测为六种癌症类型细胞网络中最普遍的(补充图4A)。此外,我们接下来分析了患者中这些亚簇之间的各自比例之间是否存在任何相关性,并发现了一些共现的细胞亚簇(补充图4B和补充表6),例如一些成纤维细胞和癌症细胞亚簇之间在BC和OV中相关的比例。
鉴于癌症细胞与髓细胞以及基质细胞之间的串扰被预测为普遍存在,我们重点分析了这些细胞类型之间的相互作用,并询问了它们如何以特定方式相互影响以促进癌症进展(图4A和补充图5)。在BC和OV中,基质细胞是与癌症细胞相互作用的广泛细胞类型(图4A和补充图5)。胰岛素样生长因子1(IGF1)可由基质细胞分泌,通过结合其在癌症细胞上的受体来调节癌症细胞的生长。癌症细胞表达的胰岛素样生长因子1受体(IGF1R)基因与BC中的雌激素反应信号高度相关,这可能表明IGF1对IGF1R的结合作用以及激活雌激素信号增强了癌症的生长(图4B)。S型蛋白酪氨酸磷酸酶受体(PTPRS)在OV癌症细胞中高度表达,并与MYC/E2F靶点相关,表明多效性蛋白(PTN)由与其受体结合的成纤维细胞分泌,以促进癌症细胞生长(图4B)。相应地,IGF1R和PTPRS的表达分别与BC和OV中的雌激素反应相关基因ESR1和MYC靶基因SLC2A1呈正相关(图4B)。此外,癌症细胞亚簇[CS1(簇0)]和间质细胞亚簇(FS3和FS4)的比例在BC中也显示出正相关(图4C)。这些结果表明,成纤维细胞可能通过表达和分泌不同的生长因子来促进肿瘤细胞增殖。
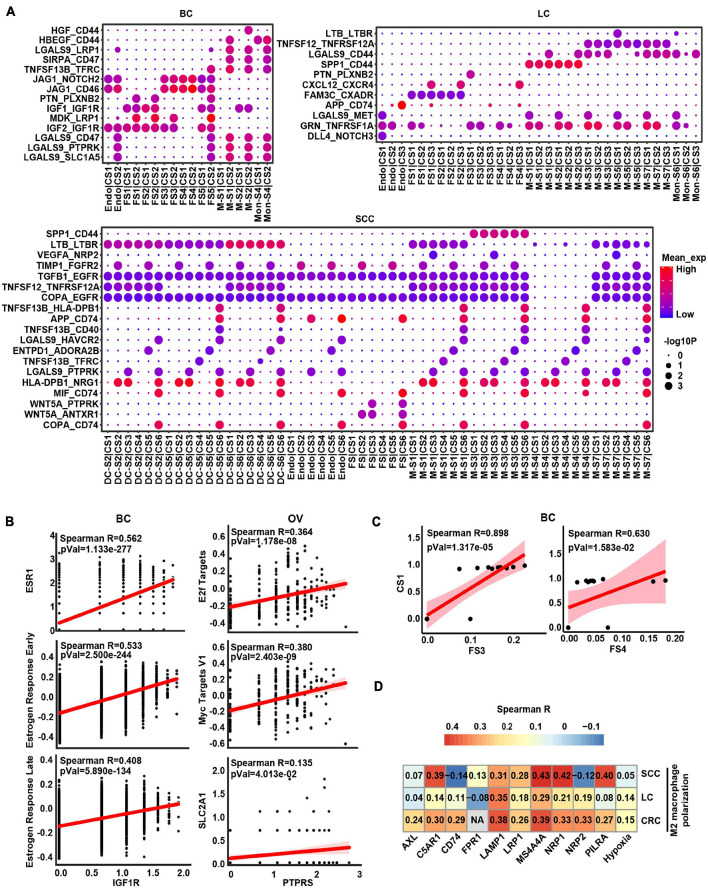
5. 肿瘤相关巨噬细胞可能促进癌症细胞的上皮-间充质转移
为了研究巨噬细胞通过常见的L–R对(TNFSF12–TNFRSF12A和SPP1–CD44)对肿瘤细胞的特异性影响,我们进一步计算了癌症细胞中TNFRSF12 A或CD44表达与标志性特征评分之间的相关性。结果显示,血管生成、糖酵解和EMT是与CD44表达最相关的生物学过程,而在癌症细胞中,通过NFκB、血管生成、IL6_JAK_STAT3途径和EMT的TNFα信号传导与CRC、LC和SCC中的TNFRSF12A相关(图5A和补充表7)。由于SPP1主要在巨噬细胞中表达(补充图6A),我们进一步检测到SPP1+TAMs的相对丰度[LC中的M-S2(簇1)和CRC中的M-S3(簇2)]以及EMT高的癌症细胞亚簇[CC中的CS1(簇0)和CRC中的CS2(聚类1)]在LC和CRC中相互关联,这进一步加强了SPP1+TAM促进EMT的功能(补充表2和图5B)。
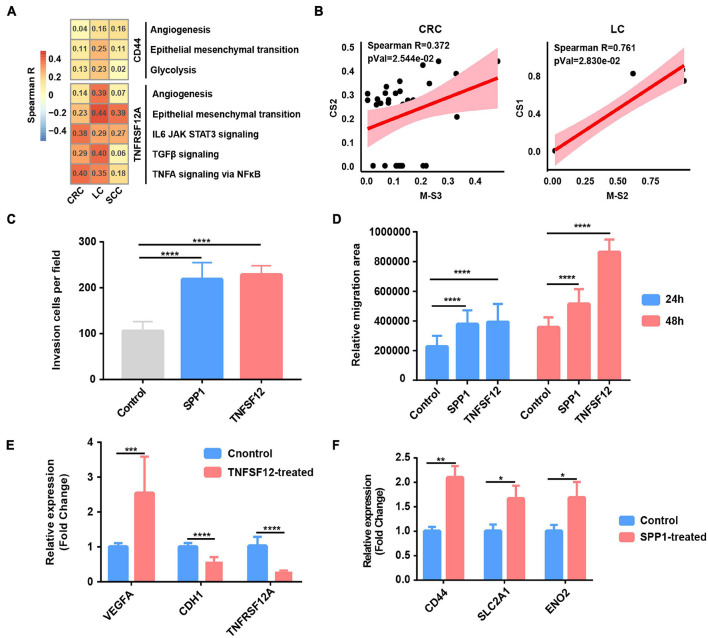
6. SPP1在缺氧肿瘤微环境中上调与预后不良有关
由于发现SPP1+TAM具有较高的缺氧评分(图2B)和与EMT癌症细胞共现(图5B),我们专注于探索SPP1和SPP1+TAMs的功能。与正常组织相比,肿瘤样本来源的巨噬细胞中SPP1的表达上调(图6A);我们推断SPP1是TAMs中TME诱导的特异性表达程序。TCGA癌症样本进一步证实了这些发现,表明与邻近的正常组织相比,在相应的癌症类型中观察到肿瘤组织中SPP1的表达高得多(补充图7A)。同时,发现PDAC和LC含有更高比例(>50%)的SPP1+TAM(补充图7B)。利用从TCGA项目收集的临床数据,我们证实,SPP1基因表达水平较高的患者在六种癌症类型中表现出较差的预后,包括本研究中研究的癌症(图6B),SPP1+TAM比例较高也与较差的临床结果相关(补充图7C),表明SPP1和SPP1+TAMs对癌症的临床影响。
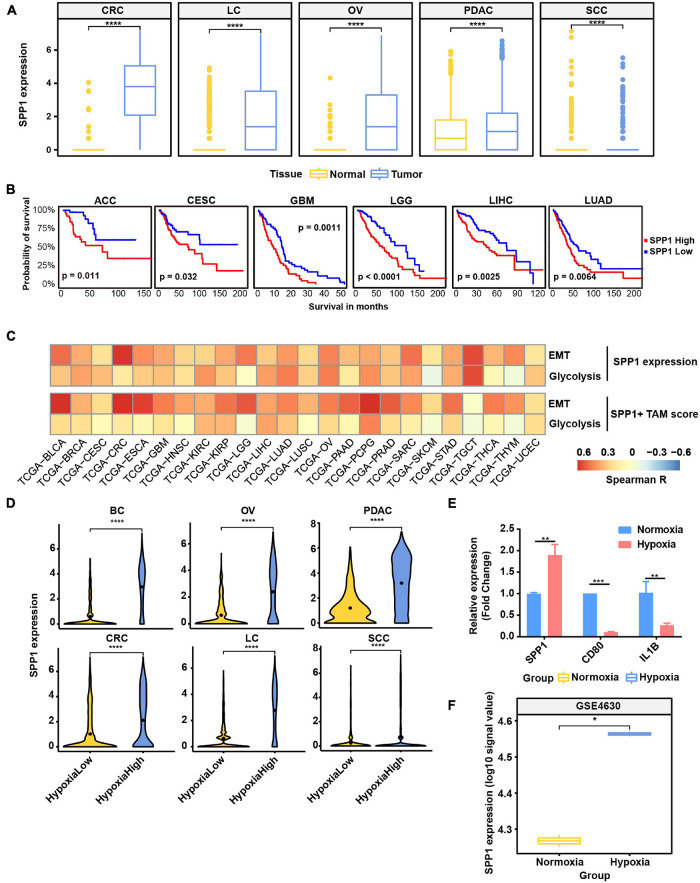
7. 缺氧可能影响不同肿瘤浸润细胞类型的生物学特性和功能
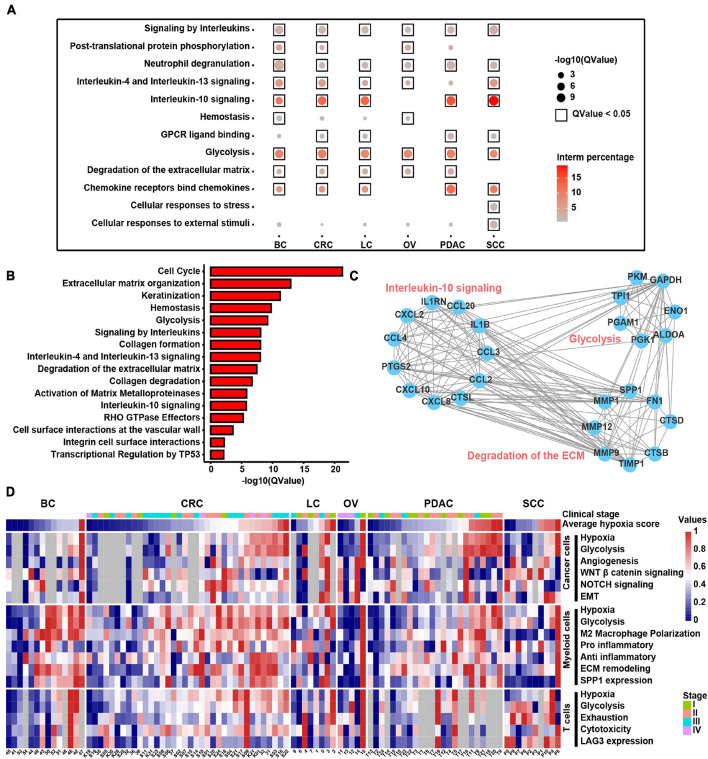
为了发现缺氧对不同细胞类型基因表达谱的影响,我们通过DEG分析(1.5倍差异,adj.p<0.05)和T细胞、成纤维细胞、髓细胞和癌症细胞中DEG的Reactome项富集分析(adj.p>0.01)比较了低氧高细胞和低氧低细胞的基因表达。由于T细胞和成纤维细胞中的DEG较少,我们主要关注髓细胞和癌症细胞(补充表8)。在髓系细胞中的DEGs中,SPP1和TIMP1是跨癌症缺氧高细胞中上调最显著的基因(补充图9A)。如图7A所示,包括IL4、IL13和IL10信号在内的白细胞介素信号在缺氧高髓系细胞中富集,表明免疫抑制细胞因子在缺氧TME中被激活。此外,在六种癌症类型中,ECM的降解和糖酵解在低氧高髓系细胞中是活跃的。然而,除糖酵解外,低氧高癌症细胞中的富集途径因癌症类型而异,表明组织对低氧的特异性反应(补充图9B)。此外,我们纳入了25种TCGA癌症类型,并进行了DEG分析。根据DEG,在超过13种癌症类型中,有489个基因在低氧高肿瘤和低肿瘤中上调(补充表7)。我们发现,IL信号传导和ECM降解以及糖酵解在缺氧高肿瘤中显著富集(图7B)。TCGA癌症中也发现了基质蛋白多糖的生物过程,如胶原蛋白形成、胶原蛋白降解和整合素细胞表面相互作用。此外,我们发现,在六种癌症类型的缺氧髓细胞中上调的DEG在蛋白质-蛋白质相互作用网络中频繁相互作用(图7C)。总之,这些结果表明,在缺氧TME条件下,这些高表达分子之间的串扰可能在不同癌症类型的发展和进展中发挥关键作用。
参考文献:
[1] Wei J , Chen Z , Hu M ,et al.Characterizing Intercellular Communication of Pan-Cancer Reveals SPP1+ Tumor-Associated Macrophage Expanded in Hypoxia and Promoting Cancer Malignancy Through Single-Cell RNA-Seq Data[J].Frontiers in cell and developmental biology, 2021, 9:749210.DOI:10.3389/fcell.2021.749210.
