
编者按
食管癌是全球第八大最常见的癌症,其发病率存在显著的地理差异。食管癌主要有两种组织学亚型构成:食管鳞状细胞癌(ESCC)和食管腺癌(EAC)。近30年来,食管腺癌在西方国家已成为主要亚型,且发病率发生率逐年增加,近5年生存率低于15%。最近,通过全基因组测序研究发现食管腺癌是一种高突变的癌症,因此理论上可以根据患者的显性特征提供治疗方案,但因缺乏有效的实验模型进而阻碍了相关研究的进展。
今天,我们回顾一项于2018年发表在《Nature Communications》的经典研究——《Organoid cultures recapitulate esophageal adenocarcinoma heterogeneity providing a model for clonality studies and precision therapeutics》,该研究成功构建了具有临床注释的食管腺癌类器官模型,再现了原发肿瘤的形态、基因组和转录组情况;通过核型分析评估了类器官模型的克隆性和亚克隆随时间的演变方式;中通量药物敏感性测试证明了靶向受体酪氨酸激酶和下游介质的潜力。食管腺癌类器官模型为克隆进化和精准治疗研究提供了临床前工具。
主要研究成果
1. 为证实构建的食管腺癌类器官细胞的来源及展现出的功能性,通过免疫组化(IHC)对上皮特异性标志物进行鉴定。结果表明类器官中存在泛细胞角蛋白,没有波形蛋白表达,证实所有类器官细胞均来源于样本组织上皮。
细胞极性被破坏是评估细胞癌变的标志之一,对研究肿瘤的发生和发展至关重要。为观察细胞极性,研究者评估了F-肌动蛋白和α6整合素的表达,发现以食管腺癌样本构建的类器官内部结构紊乱,在培养过程中易出现小型腔隙结构,且不同患者的结构复杂程度和极性破坏程度存在差异。通过Ki67染色证实类器官内的细胞增殖模式与食管腺癌肿瘤一致。
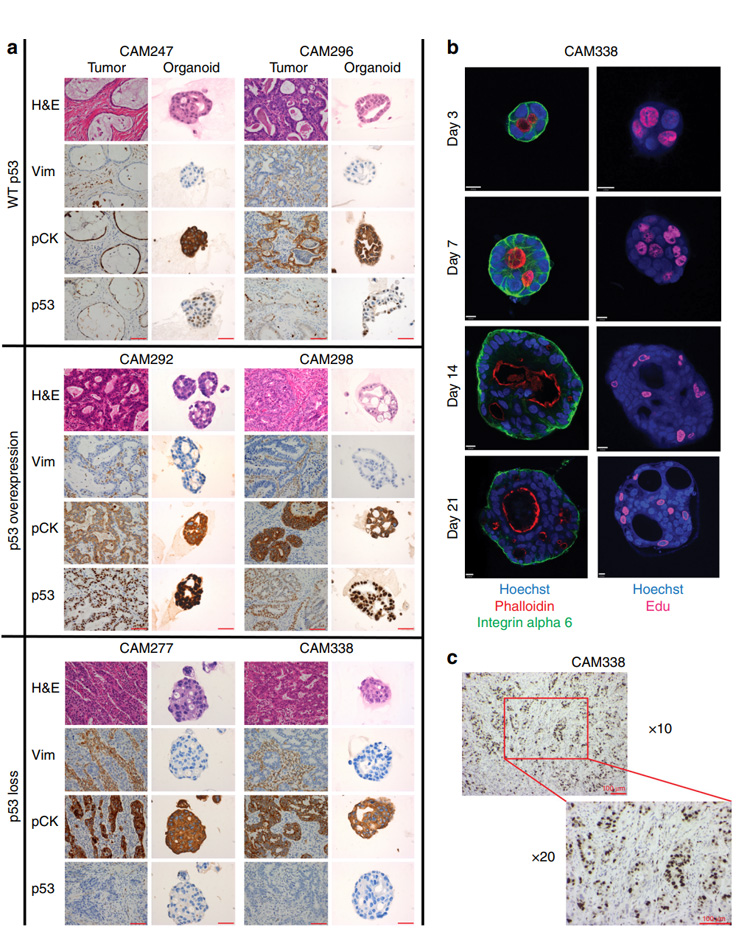
图1
2、为研究食管腺癌类器官基因组特征与肿瘤组织的相似性,研究者对类器官和配对组织进行全基因组测序。
结果表明类器官中含有一组和肿瘤一致的受非同义点突变或插入/缺失影响的异质性癌症驱动因子,且在类器官中驱动突变的等位基因频率更高。
除癌症驱动基因外,大多数单核苷酸变异(SNV)和InDels在肿瘤和类器官之间的表现是一致的。同时,在类器官中可以观察到与原位肿瘤相一致的六种突变特征,且不同患者来源的类器官也可以证实不同患者间的异质性。
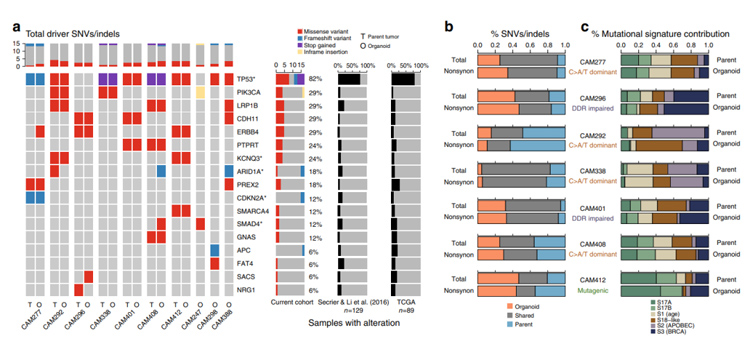
图2
3、与SNVs/InDels相比,大规模的结构变化显示出类器官与原位肿瘤之间有着更高程度的一致性,并且二者整体拷贝数图谱基本保持不变,这种一致性可以在临床上相关的RTK以及其他病灶或更大的基因组片段中观察到。
结构重排模式清楚地表明每个类器官和各自的原发肿瘤都有共同的遗传背景,即类器官与原位肿瘤具有共同的基因组景观。
总的来说,研究者从SNV、CNV和SV的角度分别比较构建的类器官和原位肿瘤基因,均都得到了非常好的一致性,表明所构建的类器官可以很好的作为体外模型来替代原位肿瘤进行研究。
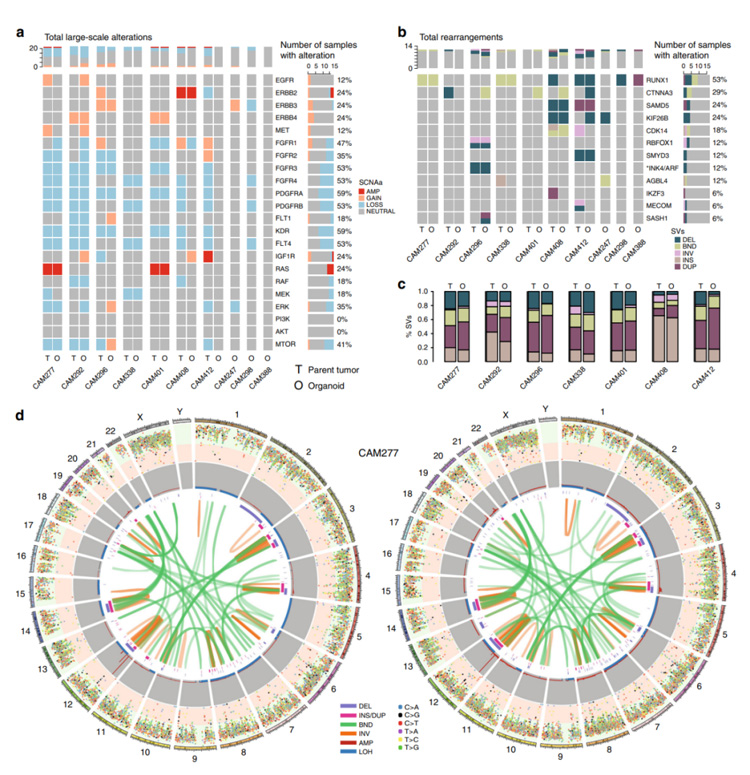
图3
4、为了解肿瘤和对应类器官之间基因表达和表达突变的关系,研究者通过mRNA测序,利用整体基因表达谱之间的欧几里得距离进行分层聚类,从而量化类器官和原位肿瘤之间的表型异同。
结果表明,患者特异性基因表达在类器官中是保守的,原位肿瘤和类器官的表达模式具有很好的相关性。在mRNA水平表达的驱动基因突变方面与DNA测序一致,原位肿瘤与类器官之间存在高度一致性。
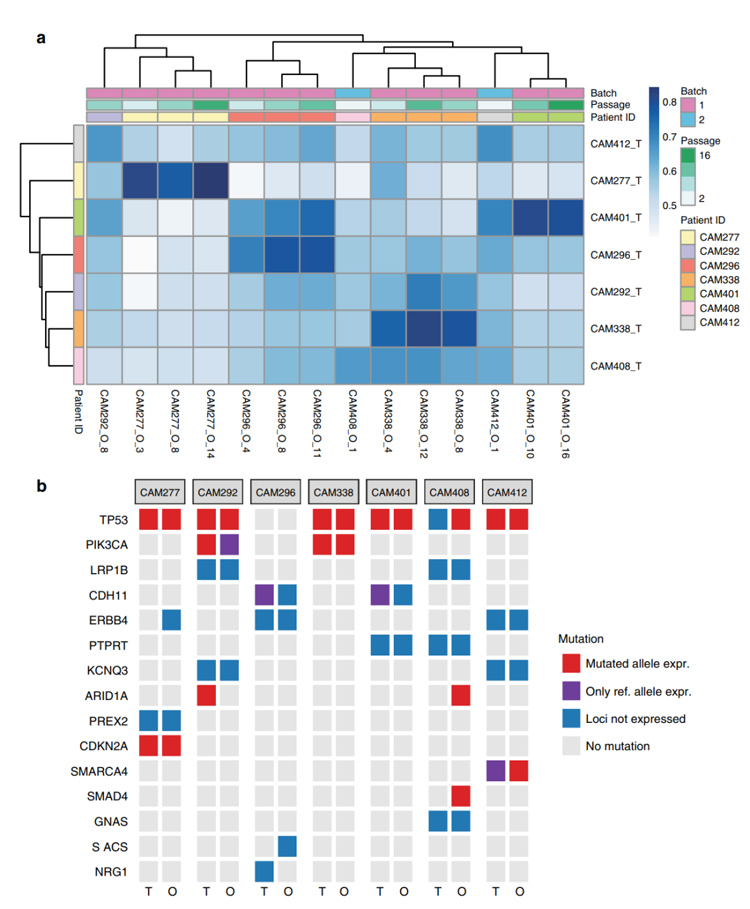
图4
5、鉴于瘤内异质性是食管腺癌的一个特征,可能会影响肿瘤的进展、患者疗效以及耐药性的出现。为解决传代过程中类器官是否保留原有层次结构及遗传表型,研究者通过分析类器官的光谱核型(SKY);对不同代数类器官进行全基因组测序;基于存在体细胞突变的等位基因频率,估计每个时间点的亚克隆结构。
结果表明,类器官中的细胞是多克隆的,在原位肿瘤组织中发现的所有克隆都具有代表性,并且无论类器官中亚克隆的动态进化如何,关于显性突变特征的基因都非常稳定,可以很好的保留原位肿瘤的内异质性和克隆动态。
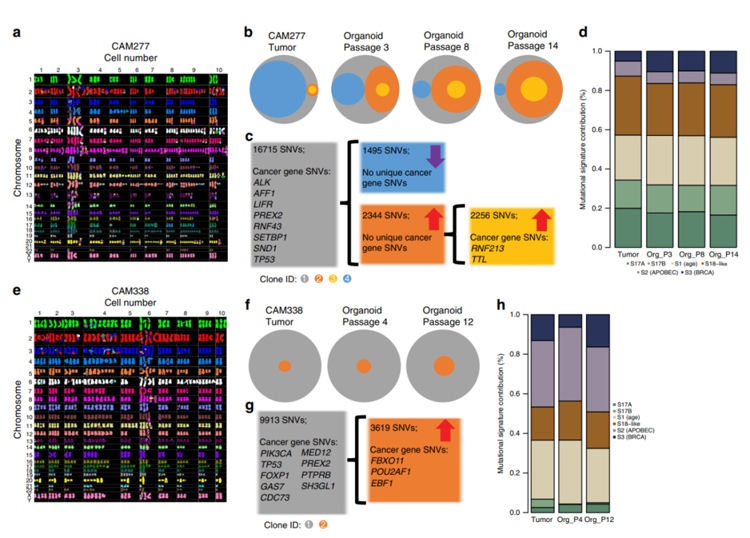
图5
6、为评估食管腺癌类器官的药物敏感性,研究者使用24种抗癌化合物对类器官进行测试。结果显示,在所有类器官中,具有重叠靶点的化合物具有相似的药物活性,且不同阶段的类器官在药物敏感性上是一致的。
此外,无论单细胞还是类器官,其药物敏感性都相似,其结果同时验证了类器官保留了与食管腺癌相同的异质性,不同来源的类器官对药物具有不同的敏感性。总体而言,构建的大多数类器官对药物缺乏敏感性,这与当前食管腺癌较差的化疗结果相符合。
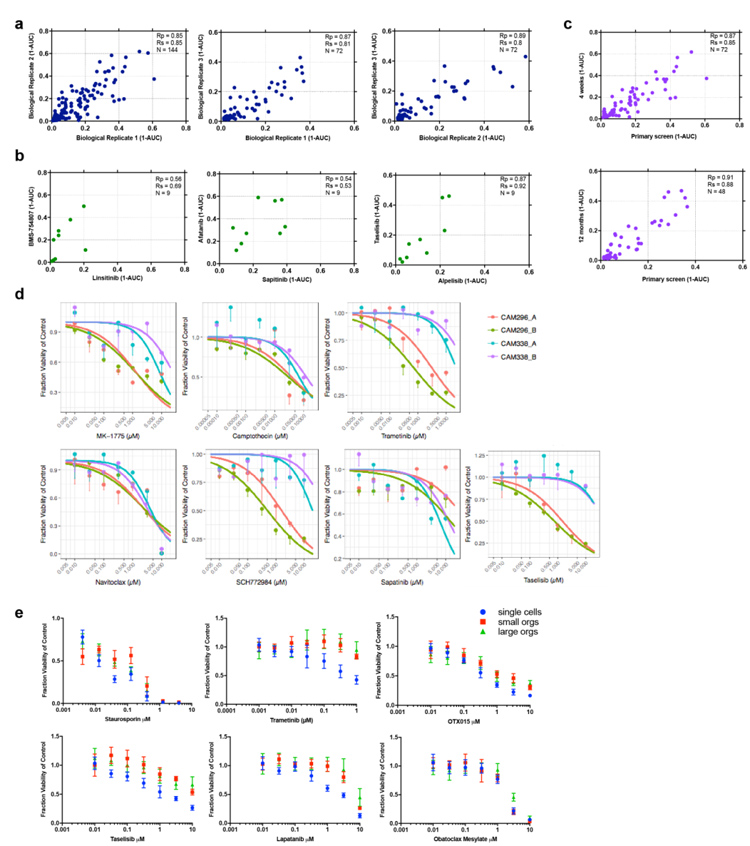
图6-1
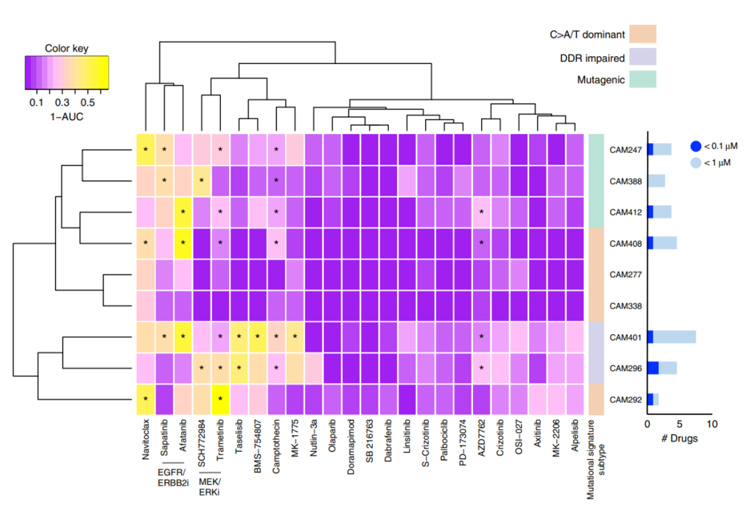
图6-2
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO、智慧实验室建设、科研服务三大业务。目前,环特类器官平台已开发多种生理类器官模型,如食管腺癌、肝、肺、肾等,欢迎有需要的读者垂询!
参考文献
[1] Ferlay, J. et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer 136, E359–E386 (2015).
[2] Fitzgerald, R. C. Barrett’s oesophagus and oesophageal adenocarcinoma: how does acid interfere with cell proliferation and differentiation? Gut 54, I21–I26 (2005).
[3] National Oesophago-Gastric Cancer Audit - 2016, Annual Report. https:// digital.nhs.uk/data-and-information/publications/statistical/nationaloesophago-gastric-cancer-audit/national-oesophago-gastric-cancer-audit2016-annual-report (2016).
[4] Secrier, M. & Li, X. et al. Mutational signatures in esophageal adenocarcinoma define etiologically distinct subgroups with therapeutic relevance. Nat. Genet. 42, 1131–1141 (2016).
[5] Garman, K. S., Orlando, R. C. & Chen, X. X. Experimental models for Barrett’s esophagus and esophageal adenocarcinoma. Am. J. Physiol. Gastrointest. Liver Physiol. 302, G1231–G1243 (2012).
[6] Weaver, J. M. J. et al. Ordering of mutations in preinvasive disease stages of esophageal carcinogenesis. Nat. Genet. 46, 837–843 (2014).
