1.介绍
利用搅拌式生物反应器(STR)在哺乳动物细胞培养中产生许多治疗性蛋白质(例如,单抗、融合蛋白、酶)。生物反应器提供了对最佳细胞生长和蛋白质生产的关键参数的控制,如温度、溶解氧(DO)和pH。根据产品和工艺的特点,重组蛋白的生产有多种细胞培养方法,包括分批、重复分批、补料分批和灌流。还使用了系列细胞类型(如CHO、NS0、BHK、PER.C6)。其中CHO是最广泛使用的。在小规模生物反应器中开发制造工艺,然后扩大到所需的大规模生产制造规模。生产规模由市场需求和工艺经济决定。目前,高达10,000-25,000L的大型生物反应器通常用于基于哺乳动物细胞培养的生物制剂生产。由于所需的流体动力学条件和培养需求的差异,细胞培养生物反应器与微生物生物反应器的设计和放大可能有很大不同。
在过去的几十年里,对生物反应器放大的了解一直在稳步增加,但大型生物反应器由于其在混合和传质方面的局限性,本质上更难操作。随着生物反应器规模的增加,混合时间的增加,都是生物反应器操作和规模平移中的一个挑战。此外,细胞、培养基和工艺的改进将细胞密度推到了更高的水平,从而对扩大规模提出了新的挑战。
近年来,一次性生物反应器在国内外得到广泛应用,一次性生物反应器已迅速应用于临床生产,并正在进入商业生产。艾贝泰生物科技有限公司现提供多种型号的一次性生物反应器。反应器中空袋主要由塑料制成,设计为一次性使用,从而消除了不锈钢(SS)设计的原位清洗(CIP)和原位灭菌(SIP)方面的问题。一次性生物反应器的使用是由改进的细胞培养过程和设施经济带来的产品高浓度驱动的。放大方法和操作与不锈钢生物反应器有很大的相似之处。但是具有独特的操作问题,例如袋压和混合,讨论了这些方面对放大的影响。
2.工程参数
表1列出了哺乳动物培养中通常认为的工程参数,随后详细描述了不同的参数。一些参数,如单位体积功率输入(P/V)和流量数(F1)取决于流型,并给出了假设完全湍流的表达式。表中还显示了不同参数之间的相互依赖关系。
表1—使用不同标准从3L生物反应器放大到20,000L生物反应器。
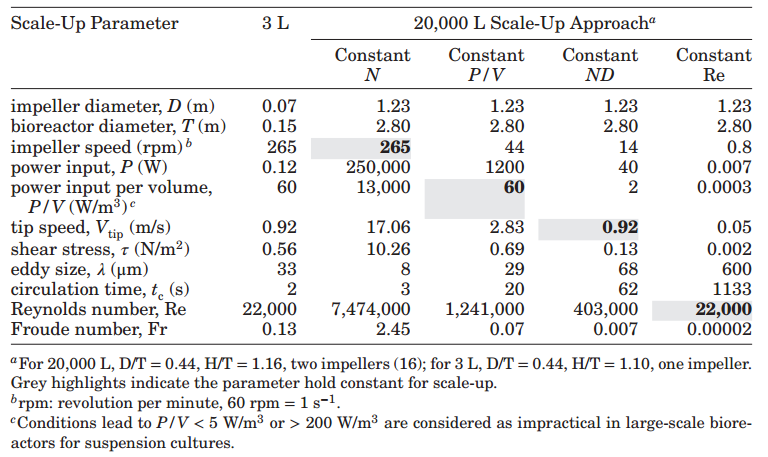
原文提供了详细的工程参数计算方式和含义的说明,本文不进行赘述。
2.1气体传输
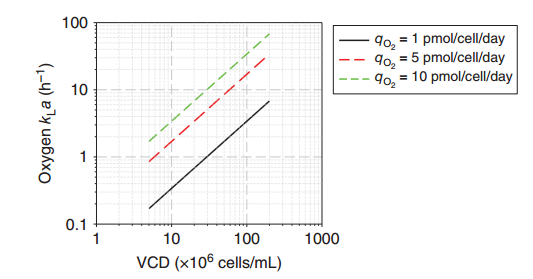
(1)O2供应:细胞培养上清液与空气平衡时的氧气浓度约为0.19 mM。细胞比氧摄取率(qO2)为4 pmol/cell/day,细胞密度为10⁹/ml的培养物在几分钟内就会消耗掉氧气。因此,必须不断地向培养物供应氧气。使用空气或氧气时,氧气的体积传质系数Kla(由氧气传递率(OTR定义)需要约为2h-1才能支持该培养。
图1细胞比氧摄取率(qO2)在1-10 pmol/cell/day范围内的哺乳动物细胞的估计Kla需要量。
(2)CO2供应: 通过逸度(pCO2)来描述的溶解CO2水平的控制,在细胞培养过程中与碳酸氢盐(HCO)的解离平衡中也是至关重要的。高溶解CO2水平会抑制细胞生长,产生代谢压力,甚至导致细胞死亡,影响培养效率和产品质量。低溶解CO2水平也可以减缓生长和影响性能,因为HCO3-介导了一些细胞过程,如戊糖磷酸途径和补充复变中间体。培养物中的细胞也通过两种机制影响溶解的CO2水平。第一种是细胞的有氧呼吸,呼吸商RQ=CER/OUR约为0.8至1。第二个经常被忽视的是培养物产生的酸,主要是乳酸,它通过以下反应与培养物中的重碳酸盐反应:
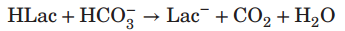
在许多培养开始时,当细胞密度低,乳酸产量高时,这种机制产生的二氧化碳可以超过有氧呼吸产生的CO2。该反应还将HCO3-转化为CO2,对pH的影响比单独产生二氧化碳的影响更大。为了保持恒定的pH值,要么必须添加碱,要么需要非常有效地去除CO2。
(3)气体传递技术和气体传递系数的确定: 细胞培养最常用的两种技术是小型生物反应器的表面转移和用于大型生物反应器的直接通气。
O2的气体传递系数Kla通常是通过经典的瞬时放气方法测量的,即用N2降低DO水平,然后用空气或氧气来提高DO水平。在N2剥离和Air/O2通气过程中,都可以使用与气体平衡的适当O2浓度;N2为0,Air为0.19 mM,O2为0.9 mM,来估算Kla。为了计算Kla,假定气体和液体和塞状流是完全混合的。在细胞存在的情况下,通过停止Air或O2通入并允许DO下降到较低水平来测量它。
CO2气体传递系数kla,由于CO2的高溶解度,气体在生物反应器中上升时会与介质中的CO2平衡。CO2的实际去除取决于通气中CO2的平衡程度。
从实验室规模的生物反应器到中试和大型的生物反应器的放大会导致气体转移过程中的损失。这会随着规模的扩大而影响培养物的O2和CO2水平。假设培养物消耗或生产相同,对于较大的生物反应器,除了最低密度的培养物外,表面气体对O2的转移是不够的。对于CO2,在从实验室规模扩大的过程中,CO2表面去除的损失是造成CO2积累的主要因素。Air通常在放大中对Sparger设计的更改以弥补损失。
2.2搅拌
搅拌最常见的放大标准是P/V如前所述。按比例放大会导致P/V随着V5/3的增加而增加,这涉及到使用比在实验规模下使用的高径比更高的容器,也就是说,在可用的设备下,尺寸上的相似性通常是不可行的。如果不使用多个叶轮,这对混合时间有负面影响。超过1:1的H:T(生物反应器高度:生物反应器直径)比,对tm∝(H/T)2.5有很强的依赖性。使用多个叶轮时,可以从单独的混合区进行较慢的混合。P/V与混合时间有关,因此代表均匀化速率。P/V 也与平均P/V相关,因此代表了潜在的水动力损伤。它是一个比例如叶尖速度更合适的比例放大。特别是按叶顶速度放大会导致混合时间过差。虽然P/V是一个很好的放大标准,但也具有一定的风险。
3.放大过程中葡萄糖代谢溢出
虽然在哺乳动物细胞培养放大过程中很少观察到葡萄糖代谢溢出,但有注意到葡萄糖/乳酸代谢随规模的增加而变化的情况,在扩大规模期间观察到葡萄糖消耗和乳酸生成率的增加。虽然葡萄糖代谢溢出的原因可能有所不同,可以肯定的是,葡萄糖代谢效率低下与培养性能受损有关。葡萄糖和乳酸代谢的这种变化导致额外的碱添加和渗透压增加,这两者都可能对工艺性能产生负面影响。
4.高密度培养
随着高灌流率和中空纤维过滤装置的应用,在灌注培养中可以达到非常高的密度,达到 50 ~ 100 × 10^6cells/mL,甚至更高。例如,使用切向流过滤系统可达到 214 × 10^6cells/mL的 CHO 细胞密度,使用交替切向流系统可达到 132×10^6cells/ mL。细胞密度增大的同时,粘度也会增大,可能在影响工艺性能。
5.规模化的一次性生物反应器设计
大多数一次性生物反应器的设计方式类似于标准的圆柱形SS搅拌生物反应器。叶轮和电机的位置根据设计而有所不同,其中使用顶部或底部安装的电机。搅拌是由预先安装的叶轮提供的,这些叶轮附着在顶部或通过支撑基座。生物反应器内的 pH、DO、温度等监测采用与传统 SS 罐类似的探针和技术。除了圆柱形搅拌槽外,还开发了采用不同几何形状和/或搅拌和混合机制的替代一次性生物反应器系统。
放大一次性反应器采用与不锈钢生物反应器类似的方法,例如,P/V仍然是反应器的推荐放大标准。反应器中的细胞培养性能已被证明与使用类似放大标准的不锈钢生物反应器中的细胞培养性能相当。
生物反应器压力:不锈钢生物反应器通常在正压下运行;在SS系统中可以压力增加,但在一次性反应系统中则不能。相反,SUBs中的压力被密切监测,以避免袋压过压(例如,某些系统<1psi;当压力超过最大允许值时,系统关闭控制器。
双曝气系统:为了实现所需的氧气传递和二氧化碳去除,通常使用双曝气系统,包括毫米孔径的通气口(如钻孔,用于空气/N2)和微米孔径的通气口(如烧结口,用于O2/CO2)。虽然双通气口也用于SS生物反应器,但毫米孔径的分散器与颗粒分散器的组合在一次性反应器中更为普遍。
这些通气口产生的气泡直径只有几到几十毫米;通常认为,在正常的PF68浓度下,它们对细胞健康的风险很低,甚至没有风险。由于这些生物反应器一次性袋是定制的,因此可以定制分散器设计以满足特定的工艺需求。
在使用时,生物反应器PID控制回路的调整可能会更加复杂。
6.一次性生物反应器混合性能的改进
在典型的放大标准下,随着生物反应器规模的增加而增加,这将增加大型生物反应器中添加极端pH值溶液时的pH非均质性。混合的改进有望进一步提高工艺性能,因为混合不充分会导致局部pH梯度,会对哺乳动物培养物的性能产生负面影响。可以通过优化叶轮配置、生物反应器长径比和挡板设计来优化。艾贝泰生物科技有限公司自研的一次性生物反应器是立方体设计,具有天然挡板,增加了生物反应器内的湍流,在使用过程中具有优越的混合时间数据,在最低搅拌转速时,混合时间改善明显,将对整体培养性能产生积极影响。同样支持细胞生长和蛋白质生产。由于具有诸如改善混合条件或降低剪切等额外好处,其中一些设计可以很好地满足特定的工艺需求。
7.总结
虽然细胞培养生物反应器放大方法在过去十年中已经相对成熟,但仍在寻求进一步优化的改进。部分原因是由于生物反应器设计的局限性,由于气体传输和混合限制,历史设计可能不适合新工艺的采用。使放大性能进一步复杂化的是,许多“放大”挑战是由不同规模的生物反应器设计差异驱动的。尽管有各种各样的分散器和叶轮设计可供选择,但改造现有设施以适应不同的工艺/产品开发环境并非易事。放大性能受损通常是由于设备的差异和限制。
作为一次性应用系统中极为重要的产品体系,随着国内生物制药行业近年来的高速发展,越来越多的用户开始关注拥有更强功能性、更高效性和易用安全的一次性生物反应器。针对研发、临床前、临床阶段以及生产阶段的商业化项目,一次性反应器都独具优势。艾贝泰作为国内始终致力于生物制药行业工艺解决方案的理想供应商。
