细胞铺板是细胞实验的第一步,将细胞铺得均匀、密度适宜是对于确保实验结果的准确性、可重复性和可信服性具有不可替代的作用。接下来随小 M 一起看看细胞铺板有哪些秘密诀窍呢~
细胞铺板是细胞生物实验起始的重要步骤,可以说是引领着一个细胞实验成败的关键!其基本原理是将一定数量的细胞均匀,密度合适的接种到培养皿中继续培养,以便后续进行一系列细胞实验。
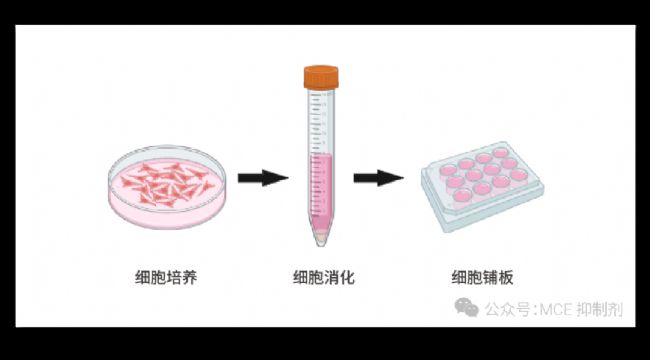
图 1. 实验流程和操作步骤。
(Created with BioRender.com)
无论是药物筛选、基因表达研究还是细胞信号通路分析,细胞铺板都是实验设计中的关键步骤。正确的细胞铺板可以确保细胞的健康生长和实验的可重复性,从而获得可靠的实验数据。
01
细胞铺板实验
一、
准备工作
1. 实验材料:细胞培养皿,细胞计数仪,完全培养基,PBS,胰酶,移液枪及枪头等。
小贴士:完全培养基一般是由无血清培养基+胎牛血清 (FBS) +青霉素/链霉素双抗组成。
2. 无菌环境:实验开始前对实验材料进行清洁并无菌处理,如紫外照射。
3. 培养基预热:将完全培养基,PBS,胰酶,置于 37℃ 预热至室温,减少细胞冷应激。
二、
收集细胞
1. 选择细胞:根据实验需求选择生长速度、形态、特性等合适的细胞系或提取原代细胞。
2. 观察细胞状态:将细胞放置在显微镜下观察其生长状态及密度。以贴壁细胞为例,若培养基澄清透明且无漂浮杂质,当细胞生长至 80-90% 密度且状态良好时,则可以进行细胞传代或铺板。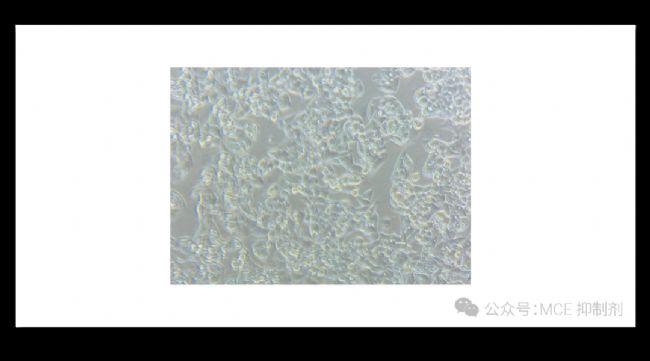
3. 细胞消化:将细胞进行传代,弃去培养基,取适量的 PBS 轻轻润洗 2-3 次,吸尽上清。加入适量的胰酶置于 37℃ 培养箱中消化 (消化时间根据细胞类型而定),待细胞皱缩且间隙变大、可从皿底滑落且不聚团成块时即可加培养基终止消化。
小贴士:应随时观察细胞消化状态,消化时间太短或太长都会影响细胞状态哦~
三、
细胞计数
将终止消化的细胞轻轻吹打,使细胞完全从皿底脱落。将细胞悬液收集至离心管中,以 800-1000 rpm,3 min 进行离心,弃上清。加入适量的完全培养基充分重悬细胞团块,轻轻吹打混匀后取 10 μL 细胞悬液与 10 μL 台盼蓝轻轻混匀,用细胞计数仪进行计数,再根据实验铺板密度的需要计算所需细胞悬液的体积。
四、
细胞铺板
▐ 确定铺板密度
1. 不同孔板铺细胞数 (以 HEK 293 细胞为例) 铺板密度
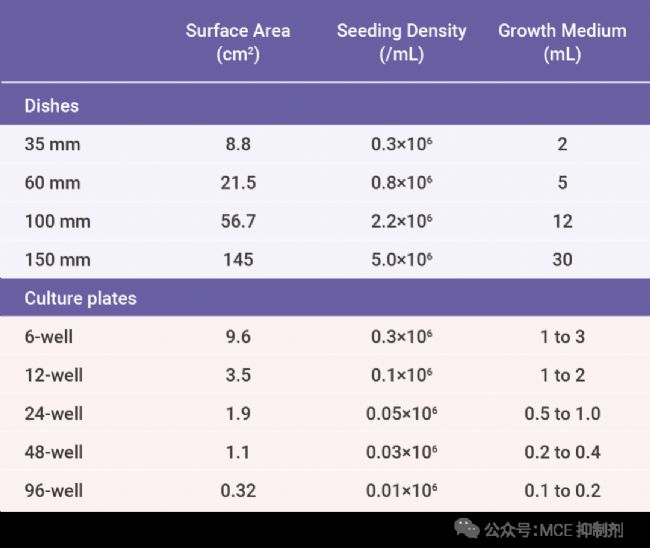
小贴士: 细胞密度太大容易造成细胞活性差和细胞死亡,细胞密度太小会造成细胞生长缓慢,产物表达降低和污染风险增加。
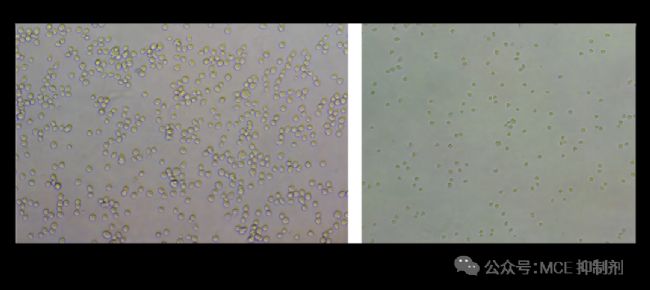
图 3. HT-1080 细胞铺板 1 h 内拍照。
密度太大(左)和密度太小(右)
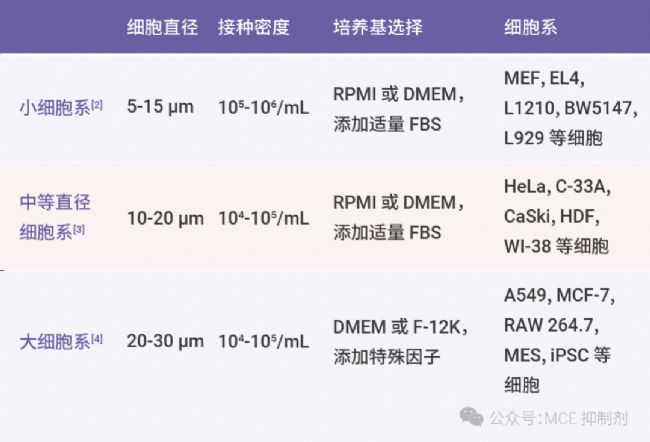
2. 不同直径的细胞系铺板密度
表 2. 不同直径的细胞铺板密度需求[1]。
小贴士:
-
接种密度:小细胞可以在相对较高的密度下生长,而大细胞需要较低的密度以避免接触抑制。
-
细胞形态:大细胞通常需要更多空间来扩展和生长。
-
时间和方法:大细胞细胞生长较慢,需要更长的时间来生长到可传代的状态。在处理和传代时,大细胞需要更温和以减少对细胞的损伤。
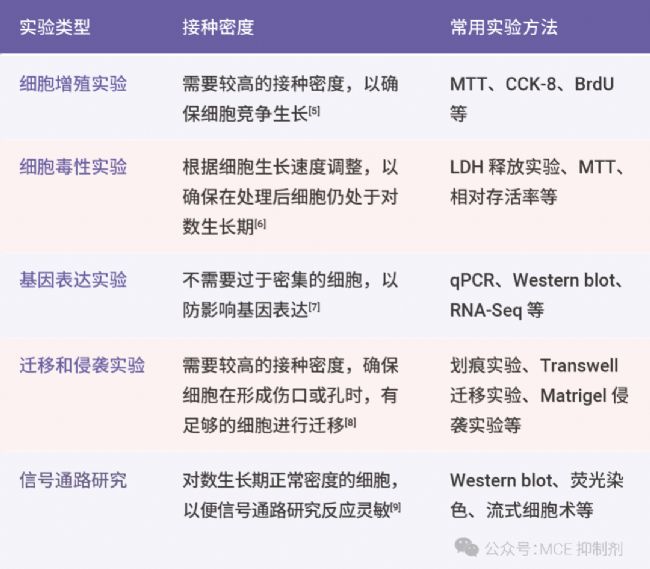
3. 实验类型
表 3. 不同实验类型的细胞铺板密度需求。
▐ 铺板操作
确定铺板密度后,根据自己所需的细胞量即可计算所需的细胞悬液体积。
举个栗子:若需要 5 mL 密度为 105/mL 的细胞量,细胞计数结果为 2×106/mL,则吸取 250 μL 的细胞悬液与 4.75 mL 的完全培养基混合即可。
用移液枪吸取适量的细胞悬液 (避免吸取气泡),在培养皿上方竖直悬空均匀、缓慢地滴加在各个角落。盖上培养皿后沿着水平桌面采用“8”字法或者“十字”形轻轻摇晃培养皿,重复 5-6 次确保使细胞均匀分布在培养皿中,然后进行铺板操作[10]。
小贴士:如何铺的均匀?
答:“8” 字法 or 十字混匀法。
1. 96 孔板:
充分混匀细胞悬液后 (避免产生气泡),用排枪吸取计数后一定体积的细胞,枪头与孔壁呈 45 ℃ 沿壁缓慢并均匀地将细胞悬液分配到每个孔中。若加样孔太多,建议每铺一部分及时混匀细胞悬液。在接种完成之后,盖上 96 孔板,静止 3-5 min。

图 4. 在 96 孔板中铺 HT-1080 细胞演示 (左),铺板 1 h 内拍照 (右)。
2. 其他孔板或者培养皿:
- 8 字法:以 24 孔板为例,细胞铺完后,贴着水平桌面画 “8” 字轨迹,重复 5-6 次。
- 十字混匀法:以 24 孔板为例,细胞铺完后,贴着水平桌面先上下移动,再左右移动,呈十字形状,重复 5-6 次。
小贴士:
- 摇晃过程中应注意力度,防止培养基溅洒出来污染细胞哦~
- 细胞易沉降,建议每铺一部分孔 (比如半块板),及时混匀预先配制的细胞悬液,然后继续铺板。
▐ 后续观察
铺完细胞后记得显微镜下观察确认细胞的均匀度和密度,如果你能观察到细胞“颗粒”分明、分布均匀且密度中等,那么恭喜你,细胞铺板工作你已经完美结束啦~赶紧将你的细胞放回恒温培养箱中继续培养啦!
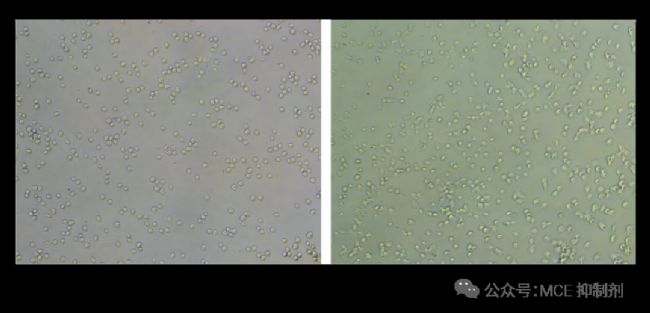
图 5. 成功铺板后的 HT-1080 细胞 0 h(左)和 2 h(右)。
最后!!!千万不要铺完细胞就撒手不管啦~细胞也是有生命的,需要被时时“关爱”与“呵护”的哦~
- 定期使用显微镜观察细胞形态、增殖情况。
- 记录细胞生长曲线,评估实验效果。
- 根据实验目的,适时进行细胞处理 (如药物添加、转染等),并继续观察细胞。
02
常见问题及可能原因
一、铺完细胞后状态不佳
可能性原因:
1. 细胞的消化时间过长导致细胞损伤,会影响细胞的生长和代谢功能;
2. 细胞培养过程中出现细菌、真菌或霉菌等污染(如果细胞被支原体感染,可尝试用支原体清除剂处理);
3. 细胞密度过大或过小,影响细胞生长状态;
4. 细胞吹打用力造成细胞机械损伤,影响细胞正常生命活动;
5. 检查培养基,优化培养环境,确保用来铺板的细胞传代次数不多,细胞活力好。
二、细胞密度不均匀
可能性原因:
1. 细胞的消化时间过短或过长,导致细胞消化不充分或细胞结团率太高;
2. 细胞本身性质,偏向于成团生长,如 HepG2。
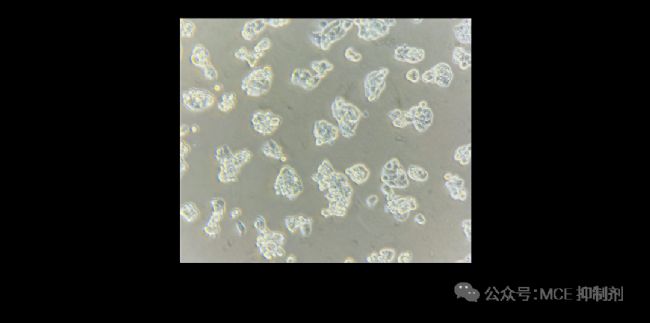
图 6. 聚团生长的 HepG2 细胞。
3. 计数和铺板时,细胞重悬吹打次数太少,未充分混匀,细胞密度分布不均匀;
4. 在进行液体分配时,技术不一致或操作不当可能导致分配不均;
5. 培养环境中的 pH、温度或 CO2 浓度等参数不适合细胞,会影响生长和移动。
三、细胞形态异常或死亡、凋亡
可能性原因:
1. 细胞密度过大或过小,过度拥挤或稀疏;
2. 培养条件不当对细胞造成损伤,比如温度、气体成分和培养基;
3. 培养基组分出现过期或变质;
4. 在重悬和铺板过程中,强烈摇晃或过度机械性操作。
03
小结
除了以上的秘密小技巧外,细胞铺板也离不开操作手法上的经验积累。希望能够帮助到每一位科研工作者顺利、圆满的得到自己想要的实验结果哦!
|
产品推荐 |
|
DMEM (High Glucose, L-Glutamine, Pyruvate, Phenol Red, no HEPES) (HY-K3001) 适于 Hela、293、Cos-7、PC-12、原代成纤维、神经元、神经胶质、人脐带静脉内皮、平滑肌等细胞 |
|
DMEM/F-12 (1:1), L-Glutamine, Phenol Red, HEPES (HY-K3002) 适于 MDCK、神经胶质、成纤维和人内皮等细胞 |
|
DMEM (Low Glucose, L-Glutamine, Pyruvate, Phenol Red, no HEPES) (HY-K3003) 适于 Hela、293、Cos-7、PC-12、原代成纤维、神经元、神经胶质、人脐带静脉内皮、平滑肌等细胞 |
|
RPMI 1640 (L-Glutamine, Phenol Red, no HEPES) (HY-K3004) 适于 HeLa、Jurkat、 MCF-7、PC12、PBMC、星形胶质和癌细胞等细胞 |
|
Fetal Bovine Serum (Superfine), Uruguay (HY-T1000) 特级胎牛血清 |
|
PBS (1×) 磷酸盐缓冲液 |
|
MEM Non-essential Amino Acid Solution (100×) (HY-K3011) MEM 非必需氨基酸溶液(100X) |
|
L-Glutamine (100×), Sterile (HY-K1046) L-谷氨酰胺 (100×),一种必需氨基酸 |
|
0.25% Trypsin-EDTA (1×), phenol red (HY-K3007) 适于细胞解离、常规细胞培养传代及原代组织解离 |
|
支原体清除试剂 |
|
Penicillin-Streptomycin (100×), Sterile (HY-K1006) 青霉/链霉素双抗溶液 |
参考文献:
[1] Bäckström A, et al. A Sample Preparation Protocol for High Throughput Immunofluorescence of Suspension Cells on an Adherent Surface. J Histochem Cytochem. 2020 Jul;68(7):473-489.
[2] Hsu SH, et al. The effect of dynamic culture conditions on endothelial cell seeding and retention on small diameter polyurethane vascular grafts. Med Eng Phys. 2005 Apr;27(3):267-72.
[3] Zhao Y, et al. Three-dimensional printing of Hela cells for cervical tumor model in vitro. Biofabrication. 2014 Sep;6(3):035001.
[4] Foster KA, et al. Characterization of the A549 cell line as a type II pulmonary epithelial cell model for drug metabolism. Exp Cell Res. 1998 Sep 15;243(2):359-66.
[5] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983 Dec 16;65(1-2):55-63.
[6] Wu YK, et al. The Influence of Cell Culture Density on the Cytotoxicity of Adipose-Derived Stem Cells Induced by L-Ascorbic Acid-2-Phosphate. Sci Rep. 2020 Jan 9;10(1):104.
[7] Heng BC, et al. Effect of cell-seeding density on the proliferation and gene expression profile of human umbilical vein endothelial cells within ex vivo culture. Cytotherapy. 2011 May;13(5):606-17.
[8] Pijuan J, et al. In vitro Cell Migration, Invasion, and Adhesion Assays: From Cell Imaging to Data Analysis. Front Cell Dev Biol. 2019 Jun 14;7:107.
[9] Nallet-Staub F, et al. Cell density sensing alters TGF-β signaling in a cell-type-specific manner, independent from Hippo pathway activation. Dev Cell. 2015 Mar 9;32(5):640-51.
[10] Dr. Jessica Wagener. Cell seeding protocol-Guide on how to seed cells correctly. Lab Academy. 2021 April 13.
