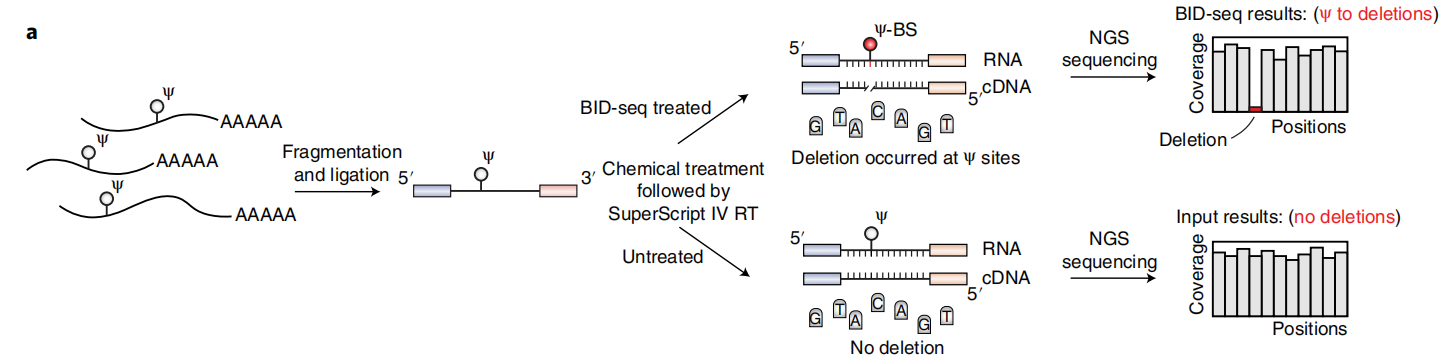
转录后的RNA修饰在所有生命形式和所有类型的RNA中均会发生。其中,假尿嘧啶(Ψ)是一种常见的RNA修饰,可以影响不同RNA的不同生物学功能。目前,在哺乳动物的mRNA中也发现了这种修饰。作为哺乳动物mRNA上丰度第二高的修饰,Ψ在mRNA中是否发挥着重要的调控功能目前尚不完全清楚。由于无法在单碱基分辨率下全面、定量地检测Ψ,其生物学功能的进一步研究受到了阻碍。
针对这一问题,2022年10月27日,美国芝加哥大学何川教授团队在Nature Biotechnology 杂志上发表了标题为“Quantitative sequencing using BID-seq uncovers abundant pseudouridines in mammalian mRNA at base resolution”的研究论文,该研究开发了一种名为BS诱导的缺失测序法(Bisulfite Induced Deletion sequencing, BID-seq)。该方法可以在不影响胞苷的的情况下,将Ψ定量地转化为“Ψ-BS加合物”,导致逆转录后在含有Ψ位点处出现碱基缺失信号。最终,利用该方法实现了单碱基分辨率下对mRNA上Ψ修饰的定量测序。上海云序生物新推出本研究中对应的“假尿嘧啶定量测序服务(BID-seq)”,用成熟、精准的测序技术助力研究Ψ在各种生物过程中的作用!

发表期刊:Nature Biotechnology
影响因子:47
发表时间:2022年10月27日
研究方法:BID-seq、RNA-seq、RT-qPCR
文章链接:Quantitative sequencing using BID-seq uncovers abundant pseudouridines in mammalian mRNA at base resolution
详细文章解析请点击此处了解
引 言
之前对RNA中Ψ的检测主要依赖于它与N-环己基- N ' -(2-形态喹lin乙基)碳二亚胺甲基-对甲ben磺酸 (CMC) 反应生成CMC修饰的Ψ,进而在逆转录(RT)过程中产生终止信号。该方法已被用于转录组范围的Ψ映射(命名为“Ψ-seq”或“Pseudo-seq”),确定了人类mRNA中少量的Ψ位点,然而两个独立数据集之间只有13个位点重叠,仅占LC-MS/MS测得的人类mRNA中Ψ位点一小部分。此外,叠氮化物修饰的CMC已被用于富集Ψ的RNA片段进行测序(CeU-seq),允许检测更多Ψ位点。然而,该方法缺乏碱基分辨率和修饰位点的化学计量学信息。
利用最近报道的亚硫酸氢盐(BS)对Ψ的反应性,我们在这里报道了BS诱导缺失测序(
BID-seq)(云序生物可提供)作为Ψ定量和转录组范围定位的碱基分辨率方法。我们发现了一种BS反应条件,可以在没有胞嘧啶脱氨的情况下将Ψ定量地转化为Ψ-BS加合物,从而在逆转录过程中导致Ψ位点的独特缺失特征。我们使用BID-seq检测HeLa细胞中单个PUS酶敲低后部分改变的Ψ位点,并鉴定mRNA中Ψ位点的“writer”蛋白。我们在小鼠组织中观察到比在人类细胞系中更多的Ψ-modified mRNA位点,高Ψ修饰的转录本显示出更高的丰度和组织特异性特征。我们发现TRUB1是调节mRNA稳定性的主要mRNA Ψ“writer”蛋白。我们还在哺乳动物mRNA的终止密码子中发现了一些Ψ位点,并证实了Ψ在体内具有促进终止密码子读取的作用。
研究内容
1、一种新的BS处理能定量地将“Ψ”转化为“Ψ-BS加合物”
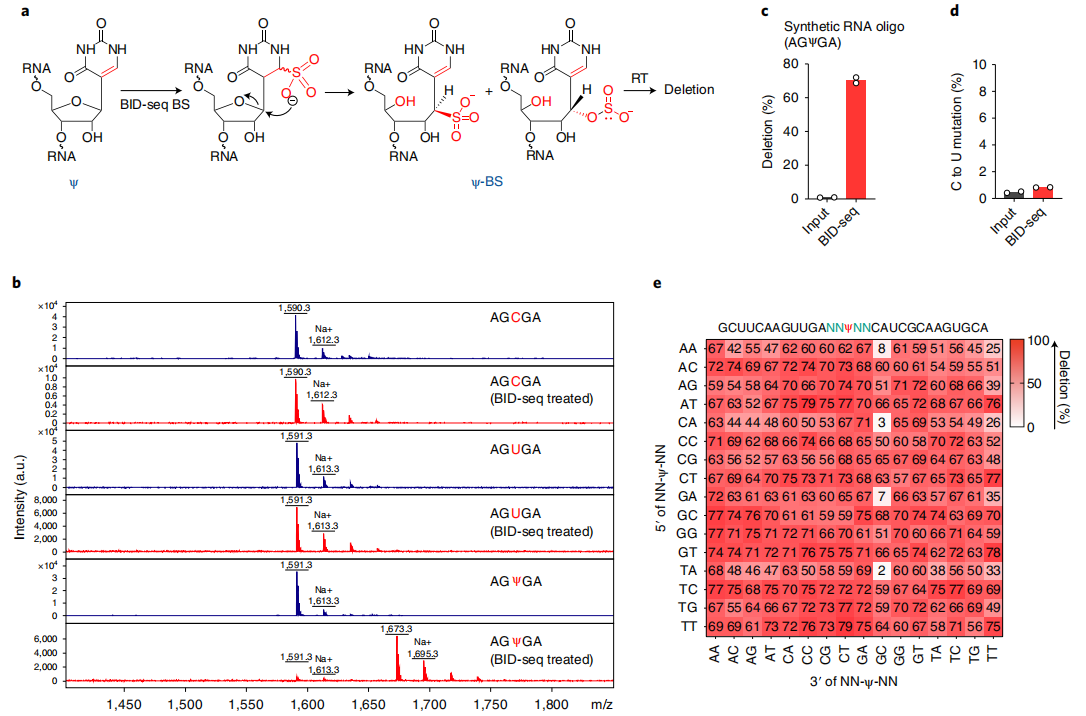
在最近一项RNA定位m5C的研究中,Khoddami等人观察到了一个令人惊讶的现象,即BS处理可能导致RNA中Ψ位点的适度碱基缺失(RBS-seq)(图1a)。Ψ-BS加合物的形成被证明是导致逆转录时缺失读出的关键中间体。在人类18S和28S rRNA中共检测到15和20个Ψ位点(缺失率>5%),但在人mRNA上的信号较弱,仅检测到78个位点的缺失率大于5%。RBS-seq中传统的BS反应条件不可避免地将所有胞嘧啶转化为尿嘧啶,从而降低了读取的复杂性,导致显著比例的reads不能与mRNA外显子对齐。然而,在RT过程中发现的Ψ-bs加合物诱导的缺失为潜在的Ψ检测提供了一个全新的原理。
根据这些有趣的观察,作者测试了两种商业亚硫酸氢盐试剂盒(Zymo和Epigentek),用于对合成的5-mer RNA寡核苷酸AGXGA(X = C或Ψ)的常规BS处理。在这两种情况下,都观察到了C→U的定量转换,但没有Ψ-BS加合物的形成。然后,作者检查了已发表的RBS-seq条件来测量Ψ到Ψ-BS加合物的转换效率。虽然基质辅助激光解吸/电离飞行时间(MALDI-TOF)质谱显示了定量的C→U转换,但Ψ-BS加合物形成的效率存在差异,在4个重复中小于30%(图1a),这也解释了使用先前方案检测Ψ的低灵敏度的原因。
众所周知,在酸性pH(约5.1)下,胞嘧啶中N3的质子化对BS介导的脱胺作用至关重要,而中性pH更适合BS与尿嘧啶的反应。因此,推断中性pH会抑制C→U的转化,但会促进Ψ与BS的反应,从而产生更高水平的Ψ-BS(图1a)。事实上,在中性pH下对模型RNA探针进行BS处理,然后进行MALDI-TOF MS,结果显示Ψ到Ψ-BS加合物的定量转化,没有检测到任何的C→U的转化(图1b)。
为了优化Ψ检测,本文在中性pH下用BS处理了一个含30-mer Ψ的 RNA探针(含有AGΨGA基序),并筛选了商业逆转录酶。发现在新的BS处理后,经过RT、扩增和测序,SuperScript IV在完全修饰的Ψ位点上产生了高缺失率(~70%),而在未经处理的“input”中,缺失率几乎无法检测到(<1%)(图1c)。但值得注意的是,在处理和未处理的样品中,未修饰的碱基(A、C、G、U)的缺失率和C碱基的C→U转换均未检测到(图1d),表明背景非常低,潜在的胞嘧啶脱氨导致的读取复杂性没有降低。为了检验缺失率对序列上下文的依赖性,作者构建了含有NNΨNN(N = A或C或G或U)的30-mer RNA寡核苷酸文库,并进行了
BID-seq(云序生物可提供)。结果发现256个基序中有232个在Ψ位点上的缺失率超过50%,256个基序中有252个的缺失率超过25%(图1e)。经过BID-seq后,含有0% Ψ(NNUNN)的未修饰探针对大多数序列基序的缺失率小于5%;仅在少数包含ACΨ-、CUΨ-、GCΨ-、GUΨ- or -ΨUC、-ΨUG的基序中观察到高背景(约10-25%)。当调用生物样本中的Ψ候选位点时,我们将每个候选位点的缺失率设置为背景的1.5倍以上,以消除我们分析管道中背景产生的潜在假阳性。
总之,本文发现BID-seq(云序生物可提供)定量地将Ψ转化为Ψ-BS加合物,而没有检测到C→U转换,并且在逆转录过程中,大多数序列中BS修饰的Ψ位点产生高缺失率,证实了BID-seq对Ψ检测具有高度敏感性和特异性。使用含有不同Ψ水平的探针来校准序列上下文依赖的缺失率,可以进一步计算Ψ修饰位点的化学计量学。
图1 BID-seq能通过碱基缺失信号定量地检测Ψ位点
2、BID-seq的验证
为了在生物样品中验证
BID-seq(
云序生物可提供),作者开发了一种BID-seq方案,在生物样品中的各种RNA物种中绘制Ψ(图2a)。首先应用BID-seq验证了在HeLa细胞的rRNA中Ψ的检测。为了识别显著的Ψ缺失特征,作者设置了Ψ检测标准:
(1)缺失率大于5%(在BID-seq库中缺失数大于5);
(2)“input”库的删除率低于1%;
(3) BID-seq库和“Input”库的总读取覆盖深度均大于20;
(4)任何给定序列基序的背景缺失率大于1.5倍(定义为从含有0% Ψ的RNA探针中检测到的缺失率)。
此外,本研究排除了可能是假阳性的位点,特别是在已知Ψ位点的邻近核苷酸3 '或5 '上的尿嘧啶位点。
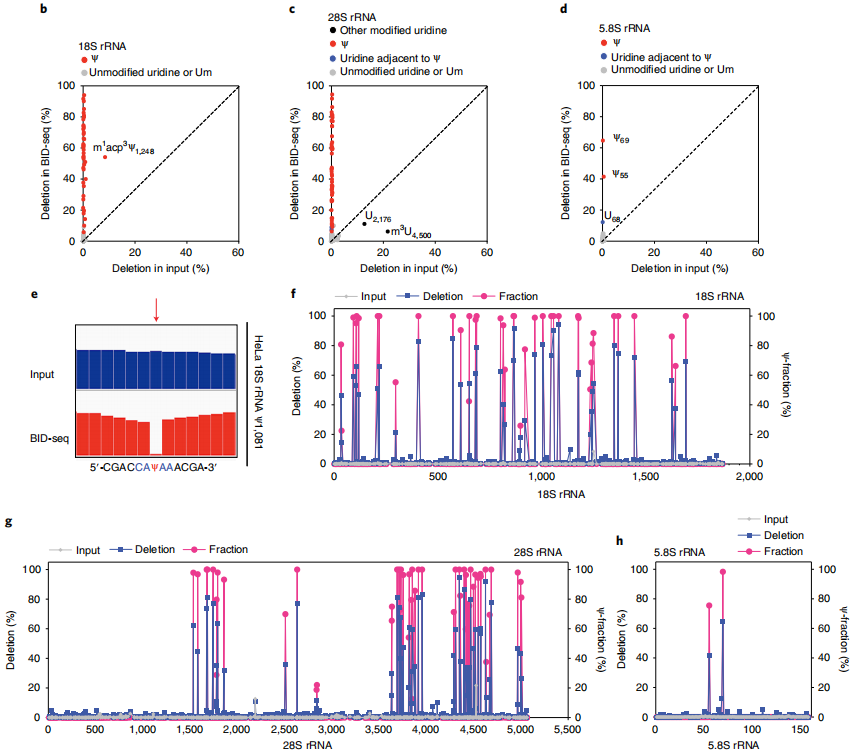
应用所有这些检测Ψ的标准,分别在HeLa 18S、28S和5.8 rRNAs22中鉴定出42、53和2个已知的Ψ位点,没有任何假阳性;这些已知的Ψ位点在BID-seq中都显示出显著的缺失率,从5%到95%不等(图2b-d)。在原始的IGV图中,可以看到HeLa 18S rRNA中具有代表性的高度修饰的Ψ1,081位点(图2e)。值得注意的是,在未经处理的“input”中,这些Ψ位点的缺失率低于1%,除了几个已知的修饰,如18S rRNA23中的m1 acp3 Ψ1,248, 28S rRNA中的m3 u4500和28S rRNA中一个有趣的未表征的u2176位点(图2b,c)。
为了通过缺失率量化每个Ψ位点的修饰率,作者混合了含有NNΨNN和NNUNN(具有不同的Ψ化学计量)的寡核苷酸探针作为对照,绘制了这些序列背景的校准曲线。232个基序的高突变率,大多数基序背景的低背景以及BID-seq中的近似双曲线校准曲线使Ψ的敏感检测和Ψ化学计量的估计成为可能。根据校准曲线,计算出这些Ψ位点在HeLa 18S、28S和5.8S RNA中的比例在20-100%左右,与质谱法测量的结果基本一致22(图2f-h)。在HeLa 18S和28S rRNA 22中,质谱分别发现了43个和61个Ψ位点,其中9个位点未被BID-seq检测到,原因有三:
(1)修饰率低:18S rRNA Ψ1,136和28S rRNA Ψ4,463;
(2)由于狭窄区域内多个高度修饰的Ψ位点(28S rRNA Ψ3,741/Ψ3,743/Ψ3,747/Ψ3,749和28S rRNA Ψ4,266/Ψ4,269)造成了剧烈的RT停止,导致Ψ位点没有读取覆盖;
(3)与Ψ位点相邻的m3 U,该位点似乎干扰了Ψ碱基上的BS反应或随后的RT: 28S rRNA Ψ4,501)。
这些都表明了BID-seq在绘制Ψ站点时的潜在局限性。
与BID-seq相比,由于缺失率低,RBS-seq在18S和28S rRNA中分别检测到15个和20个Ψ位点,其他已知的Ψ位点的缺失率接近于零。我们还将BID-seq应用于HeLa细胞的小RNA中 (<200 nt),并验证了H/ACA和C/D snoRNA中高度修饰的Ψ位点,包括Ψ-seq先前揭示的snoRNA Ψ位点。
图2 BID-seq通过修饰化学计量法检测人核糖体RNA中已知的Ψ位点
3、BID-seq绘制了人类细胞系mRNA中的Ψ图谱
作者对
BID-seq(
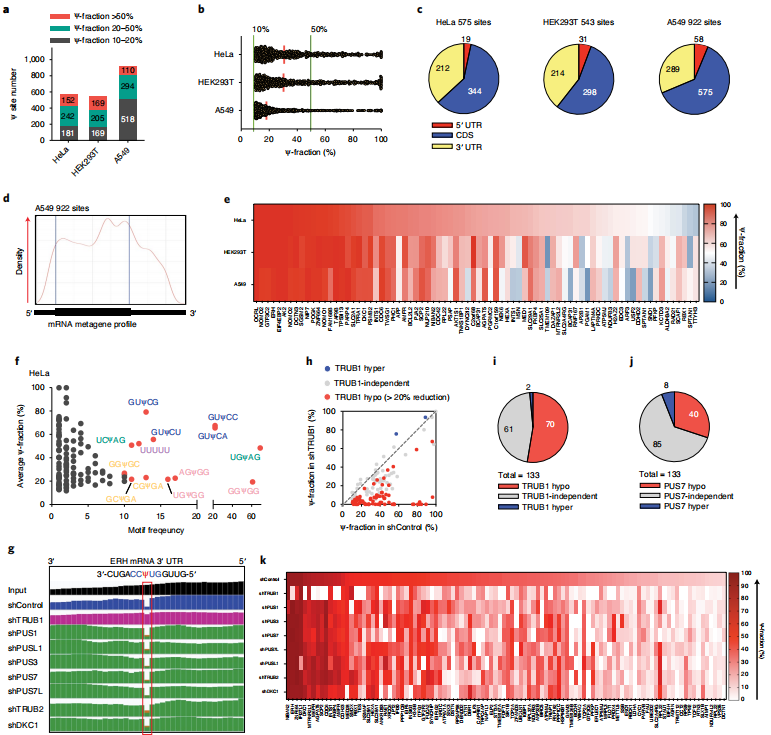
云序生物可提供)进行了优化,使其与低RNA input兼容,然后将其应用于来自HeLa、HEK293T和A549细胞的10-20ng polyA尾的RNA。除了上述Ψ检测标准外,还增加了一个Ψ修饰分数截断,并将>10% Ψ化学计量的mRNA位点作为候选位点。分别从HeLa、HEK293T和A549细胞的mRNA中鉴定出575、543和922个Ψ位点(图3a),它们都显示出明确的内部缺失特征。同时,建立了一个额外的截止标准,需要超过10的删除计数来分配人类mRNA中数百个“可靠”Ψ位点。大多数这些mRNA Ψ位点显示修饰分数为10-40%),但作者也在三种人类细胞系中发现了152、169和110个高度修饰的mRNA Ψ位点(>50% Ψ分数)(图3a), Ψ分数的连续分布从50%一直到接近100%(图3b)。mRNA Ψ位点主要分布在编码序列(CDS)和3 ' -UTR中(图3c),与之前使用CeU-seq6观察到的分布模式相似。在metagene剖面中,A549细胞中mRNA Ψ候选位点的一个例子显示在CDS区域积累(图3d)。HeLa和A549细胞的共同基因本体(GO)簇丰富了微管/细胞骨架、核糖体、膜、肌动蛋白结合、ATP结合、翻译、mRNA加工等功能。Ψ可以是共享的,也可以是细胞系特异性的。作者发现了2-3个人类细胞系共有的386个mRNA Ψ位点(>10% Ψ分数)。对于高度修饰的Ψ (>50% Ψ部分),我们在至少一种人类细胞系中鉴定出127个细胞系特异性位点和78个位点为高度修饰的Ψ,并且在所有三种细胞系中均可检测到(>10% Ψ部分)(图3e)。
接下来,分析了三种细胞系中所有mRNA Ψ位点的基序频率和修饰分数。在HeLa细胞中,最常见的基序是GUΨCN (N = A或C或G或U), USΨAG (S = C或G), poly-U (UUUUU或更多),NGΨGG (N = A或C或G或U)和GSΨGA (S = C或G)(图3f)。HEK293T和A549细胞在基序频率上也显示出相似的模式(3 h)。此前,GUΨC和UVΨAG (V = A或C或G)分别被报道为潜在的TRUB1基序和Pus7基序13,这与本文的研究结果一致。本文还绘制了每个Ψ位点的缺失率与相应mRNA的RPKM值,在当前测序深度为每个文库~80 M reads的情况下,估计RPKM=1.5作为mRNA Ψ检测的表达极限。
图3 BID-seq以单碱基分辨率检测人类mRNA中的Ψ位点,以及对单个Ψ位点修饰酶的表征
4、用于HeLa mRNA中Ψ沉积的假尿嘧啶“writer”
在人类基因组中已经注释了13种假定的PUS酶,其中已知的dyskerin假尿苷合酶1(DKC1)依赖于H/ACA snoRNAs来引导假尿苷沉积。大多数其他PUS酶被认为是独立的酶,没有snoRNAs。为了鉴定催化Ψ在mRNA中单个位点沉积的PUS酶,在HeLa细胞中对8种已知的PUS酶进行了shRNA敲除,然后进行
BID-seq(
云序生物可提供)。发现与野生型HeLa细胞相比,shControl中的Ψ修饰显著减少,很可能是由于细胞应激或慢病毒转染引起的免疫刺激。仍然能够在shControl的HeLa细胞中检测到133个Ψ分数超过10%的mRNA Ψ位点,并使用这133个位点来研究相同慢病毒感染条件下“writer”的Ψ沉积。作者比较了shControl和每次PUS敲低中每个位点的缺失率。例如,ERH mRNA 3 ' -UTR中高度修饰的Ψ位点在TRUB1敲除后Ψ分数从96%减少到8%,而其他PUS酶的敲除不影响该位点(图3g),表明该Ψ位点是由TRUB1安装的。TRUB1调控了133个位点中的70个位点(图3h,i),其中包括ERH、ZNF664、DKC1、M6PR、AGPAT5、SCP2、CDC6、INTS1、FKBP4、AMFR等转录本中的15个高度修饰位点(>50%),其中ERH、ZNF664、DKC1、M6PR、AGPAT5、SCP2、INTS1、FKBP4、AMFR和HEXA也通过Ψ-seq进行了鉴定。然后,我们分析了70个TRUB1调控的mRNA Ψ位点的基序频率和修饰分数。最常见的基序是GUΨCN (N = A或C或G或U)和poly-U (UUUUU或更多U),与BID-seq揭示的相同的主要基序一致(图3f)。
PUS7、PUS1、PUS3、PUS7L、PUSL1、TRUB2和DKC1也在HeLa转录本中分别沉积了40、28、30、24、28、28和33个Ψ位点(图3j)。本文共发现了104个(133个)Ψ位点(在shControl HeLa细胞中)对这8种PUS酶的敲除有反应,一些位点受一种特定的PUS酶调控,其他位点受到多种PUS酶的影响(图3k)。其余29个(133个)HeLa mRNA Ψ位点可能受到其他PUS酶如PUS10的调控, 如:PUS10、 RPUSD1、RPUSD2、 RPUSD3 和 RPUSD4。值得注意的是,更有效的敲除或更深入的测序敲除可能有助于更好的为shControl细胞中所有133个mRNA Ψ位点分配“writer”蛋白。
5、BID-seq检测到小鼠组织mRNA中具有丰富的Ψ位点
为了进一步研究真实组织中mRNA的假尿嘧啶情况,作者对从12只小鼠组织中分离的多尾RNA进行了
BID-seq(
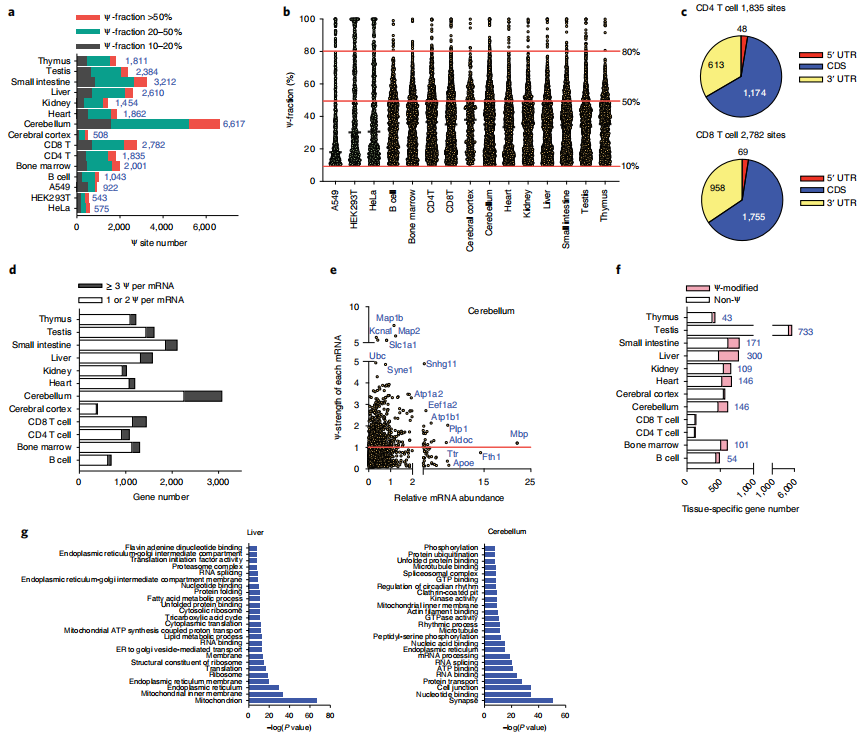
云序生物可提供)。在小鼠组织mRNA中检测到的Ψ候选位点比在HeLa mRNA中检测到的多得多,这与LC-MS/MS测量结果以及之前对小鼠脑和肺组织的分析所显示的趋势一致。具体来说,作者分别从小鼠B细胞、骨髓、CD4 T细胞、CD8 T细胞、大脑皮层、小脑、心脏、肾脏、肝脏、小肠、睾丸和胸腺的mRNA中鉴定出1,043、2,001、1,835、2,782、508、6,617、1,862、1,454、2,610、3,212、2,384和1,811个Ψ位点(>10%的比例)(图4a)。在所有12个组织中观察到许多高度修饰的位点(>50% Ψ分数),特别是在50%到80%分数之间(图4b)。与人类细胞系类似,小鼠组织中的mRNA Ψ也在CDS和3 ' UTR中积累(图4c)。在metagene图谱中,小鼠肝脏、肾脏、胸腺和CD8 T细胞中的mRNA Ψ位点分布在CDS和3 ' -UTR中,并在终止密码子周围积聚。
作者从所有12个组织中共鉴定出4008个高度修饰的mRNA Ψ位点(>50%)(图4a,b)。4008个Ψ位点中有2595个确实是组织特异性的,可以作为组织特异性的mRNA标记,在小脑、CD8 T细胞、小肠和睾丸mRNA中观察到许多组织特异性Ψ位点。虽然Ψ位点可能作为细胞类型特异性标记,但高度修饰的Ψ位点也在多个组织中共享,表明它们具有共同的功能。在4008个位点中,462个位点在至少一个组织中显示出超过50%的Ψ分数,并且在至少四个组织中可检测到(超过10% Ψ分数)。未来探索这些共享的mRNA Ψ位点在组织中的功能作用将是有趣的。
另一个有趣的观察结果是,在小鼠组织中部分假尿嘧啶化的mRNA中,每个mRNA存在多个Ψ位点(≥3个Ψ)(图4d),特别是在小脑、肝脏、CD4 T细胞和CD8 T细胞中。例如,小脑中大约25%的Ψ修饰的基因每个mRNA携带至少三个Ψ。我们使用“Ψ-strength”(定义为一个基因中所有Ψ位点的Ψ分数的总和)来测量和描述一个基因中Ψ修饰的总体水平。然后,作者绘制了Ψ-strength与标准化基因表达水平(标准化为丰富的管家基因Rps8,缺乏可检测的Ψ位点)的对比图,将所有Ψ修饰基因分组,以Ψ-strength为1.0作为截止点(图4e)。随后研究了基因表达水平,发现与低Ψ-strength(<1.0)的基因相比,高Ψ-strength(>1.0)的基因在小脑、CD4 T细胞、CD8 T细胞、胸腺和睾丸等组织中的表达水平明显更高,这表明Ψ在小鼠组织mRNA上的沉积可能有助于mRNA的稳定性。
为了进一步研究Ψ修饰基因的特征,作者将每种组织类型中的组织特异性基因(定义为在一种组织中比所有其他组织中表达更高的基因)分组,并分析了每种组织中Ψ修饰基因的数量。值得注意的是,16%、24%、22%、16%、38%和22%的组织特异性转录本分别在骨髓、小脑、心脏、肾脏、肝脏和小肠中Ψ修饰(图4f)。总的来说,数据表明假尿嘧啶化发生在小鼠的许多组织特异性mRNA中,并可能影响组织特异性生物学功能。
接下来,作者研究了非组织特异性基因在每种组织类型中的潜在功能。对这些基因在每种组织类型中的GO分析显示,在内质网、核糖体、ATP结合、核苷酸/RNA结合等方面存在共同的功能团簇,与人类细胞系的功能团簇相似(图4)。总体而言,小鼠组织清楚地显示出大量的Ψ核编码mRNA修饰;其中一些是跨组织共享的,表明它们有共同的功能。
作者在体外培养的人细胞系中检测到ND1、CO1和ND4中有5个Ψ位点,其Ψ化学计量量约为20-60%。在HeLa细胞中,PUS1似乎是ND4 mRNA上至少一个Ψ位点的“writer”蛋白。然而,Ψ在来自不同小鼠组织的线粒体mrna上更丰富;在多个mt-mRNA中检测到66个mt-mRNA Ψ位点,Ψ的比例约为20-65%。在一些组织中,一些mt- mRNA,如Nd1、Nd2、Nd4、Nd5、Co1和Atp6,含有多个Ψ修饰。这些mt-mRNA Ψ修饰的功能后果需要未来的研究。
图4 小鼠组织mRNA中含有大量的Ψ修饰
6、Ψ增加了mRNA的稳定性
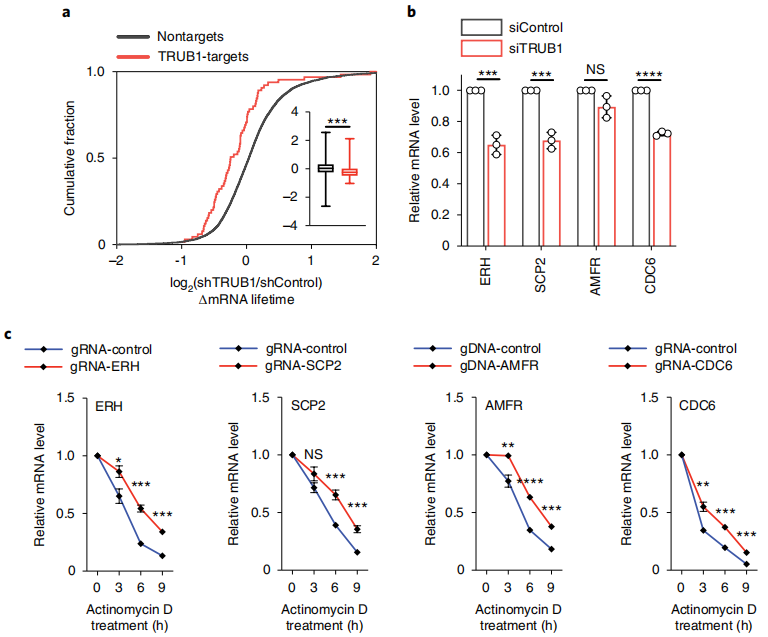
在小鼠组织中,Ψ强度高的mRNA往往更丰富。据报道,合成mRNA的假尿嘧啶化可提高其稳定性;然而,假尿嘧啶化在天然mRNA中的程度和潜在功能尚不清楚。TRUB1是在HeLa细胞的mRNA上沉积Ψ的主要酶,作者研究了它在转录稳定性中的潜在作用。已知酵母Pus4(人类TRUB1的类似物)过表达可增加细胞大小和增殖。本文还发现,TRUB1缺失可以抑制细胞生长,使细胞停留在G1期,并导致细胞大小减小。作者进一步验证了在mRNA中发现的Ψ位点,并使用基于CMC处理的方法对四个已知由TRUB1安装的高度修饰的mRNA Ψ位点,如ERH, SCP2, AMFR和CDC6,验证了TRUB1作为“writer”蛋白的功能;基于CMC的RT与定量PCR (RT- qPCR)检测在单位点Ψ检测中效果良好,并且在CMC处理和归一化到对照区域后,这四个mRNA的Ψ位点的通读率显著降低,还使用这种正交试验验证了不同基序背景下的一系列HeLa mRNAΨ位点。此外,采用已发表的“CMC-RT和连接辅助PCR分析Ψ修饰”(CLAP),通过凝胶电泳可视化和定量mRNA Ψ位点。作者选择了三个Ψ位点,周围序列适合CLAP方案,并在Ψ位点检测和Ψ化学计量学估计中验证了本文的BID-seq方法。
然后进行了TRUB1基因敲除,并通过RNA-seq研究了其对转录物半衰期的影响。注意到shControl细胞中携带TRUB1修饰Ψ mRNA的TRUB1靶标在TRUB1敲除后显示出较短的半衰期,而非靶标(未检测到Ψ)的半衰期保持不变(图5a)。本文研究了包含TRUB1调控的高度修饰mRNA Ψ位点的四个代表性基因,ERH、SCP2、AMFR和CDC6 (Supplementary Fig. 4a)。与对照组相比,在siTRUB1敲低72小时后,四个靶点中有三个的mRNA水平明显降低(图5b)。通过RT-qPCR,我们验证了TRUB1缺失降低了所有四个具有代表性的TRUB1靶标的稳定性,但没有降低非靶标mRNA的稳定性,证实了TRUB1安装的Ψ稳定了靶标mRNA。为了进一步验证trub1调控的Ψ的转录稳定作用,作者设计了一个融合的dCas13d-TRUB1系统37,并证实了位点特异性Ψ沉积可以显著延长mRNA的寿命(图5c)。综上所述,本文数据揭示了假尿嘧啶化在稳定靶mRNA中的主要功能作用。
图5 Ψ影响mRNA的稳定性
7、在mRNA终止密码子上的假尿苷化
通过体外翻译实验,Karijolich等人发现了一种独特的功能,即靶向假尿嘧啶化可以将无意义密码子转化为意义密码子并促进读取。最近,研究表明Ψ可以促进核糖体解码中心的非规范碱基配对,从而促进无义抑制。尽管有这些重要的观察结果,但Ψ是否天然存在于mRNA的终止密码子中并促进体内终止密码子的读取尚不清楚。在HeLa, HEK293T和A549细胞中,BID-seq在NDUFS2、CTSC、PLP2、MDK、SMOX、CUL3和C7 or f50mRNA中发现终止密码子中有几个“ΨGA”、“ΨAA”和“ΨAG”位点,Ψ分数从10%~40%不等(图6a)。在PUS1敲除后,NDUFS2 mRNA中ΨGA终止密码子的修饰分数显著降低(图6b)。相应地,作者观察到随着PUS1的敲低,NDUFS2的终止密码子识读率降低,而dCas13d-PUS1与NDUFS2的引导RNA (gRNA)偶联后,NDUFS2的终止密码子识读率从约3%大幅增加到约14%(图6c)。
作者还从12只小鼠组织中鉴定出106个Ψ修饰的终止密码子,其中Ψ的含量从10%到65%不等(图6d)。在所有病例中,在下游位置都发现了不含Ψ的第二终止密码子。Ψ-modified Atp5a1、Dbi、Rpl4和Tomm70a中的停止密码子在11或12个组织中是保守的,而其他的则是组织特异性的(图6d)。综上所述,本文的数据揭示了天然mRNA中终止密码子Ψ的存在,表明它们在体内作为一种替代的翻译调节机制,促进了终止密码子的读取。
在小鼠组织中的Ψ修饰的终止密码子中(图6d),作者检测了相应的蛋白质,这些蛋白质可能包括蛋白质分子量增加10%以上的潜在读过肽,以便对移位的蛋白质带进行可靠的检测。选择了10种具有可用商业抗体的蛋白质,并在7种不同的小鼠组织中测试了这些蛋白质。在这十个含有Ψ修饰的终止密码子的靶标中,观察到Selenof、Ppp1r2、Nt5c3、Szrd1和Cd52的电位读通有明显的带移。
这些带移可以在四种不同的小鼠重复序列中观察到,并存在一些个体差异。肾脏中硒的最高估计读通率约为35%,终止密码子被Ψ修饰,化学计量量约为42%。值得注意的是,对于Selenof和Ube2e3,尽管BID-seq表明存在Ψ修饰的终止密码子,在一些组织中没有观察到条带移位。有趣的是,尽管BID-seq数据显示骨髓中Cd52 mRNA的Ψ修饰的终止密码子约为12%,而其他组织中则没有,但我们发现骨髓中Cd52读穿肽的条带移位很强),这可能是由一个低Ψ修饰的终止密码子驱动的。这些观察结果表明Ψ修饰的终止密码子读取可能依赖于序列上下文,并受到未知的组织特异性机制的调节。这也还需要未来更多的研究来理解和潜在地利用这种有趣的翻译调节机制。
图6 Ψ修饰促进体内终止密码子通读
文章小结
本研究中用10-20 ng的RNA 就能在多个人类细胞系和 12 种不同的小鼠组织中检测到丰富的Ψ位点,并提供其化学计量信息。该研究进一步鉴定了mRNA上Ψ修饰的“writer”蛋白,发现高修饰Ψ位点对mRNA代谢的影响,并证明哺乳动物mRNA的终止密码子上存在天然存在的Ψ修饰。
BID-seq(
云序生物可提供)为研究mRNA上Ψ修饰在诸多生理或病理过程中的位点分布、修饰化程度动态变化、生物学功能等,奠定了技术基础,攻克了Ψ定量测序技术瓶颈,将引领RNA表观转录组领域步入新的阶段。
看了这篇文章,还只盯着m6A修饰找方向吗!RNA修饰还有这么多修饰热点等着你去探索!
云序生物专注于各类修饰,掌握市面上较为全面的各类测序方法,助力您快速筛选RNA修饰靶基因,解析RNA修饰作用机制。
快来和云序一起探索RNA修饰的未知奥秘吧!
云序生物RNA修饰研究六大模块
01 RNA修饰测序
云序生物专注于各类RNA修饰测序,掌握市面上较为全面的各类测序方法,能够快速筛选RNA修饰靶基因。云序还可提供mRNA和多种非编码RNA的测序,包括全转录组测序(涵盖mRNA,LncRNA,circRNA);LncRNA测序(涵盖LncRNA和mRNA);pri-miRNA测序(涵盖pri-miRNA和mRNA);mRNA测序;环状RNA测序等
云序生物提供以下多修饰、多分子、多方法测序服务!
下拉查看更多
m6A:
m6A MeRIP-seq(云序生物提供m6A全转录组、mRNA、LncRNA、环状RNA、miRNA、pri-miRNA、tRNA、rRNA测序服务)
m5C:
m5C MeRIP-seq(云序生物提供m5C全转录组、mRNA、LncRNA、环状RNA、pri-miRNA、tRNA、rRNA测序服务)
m5C Bis-seq(云序生物提供m5C全转录组、mRNA、LncRNA、环状RNA、pri-miRNA、tRNA、rRNA单碱基测序服务)
m1A:
m1A MeRIP-seq(云序生物提供m1A全转录组、mRNA、LncRNA、环状RNA、pri-miRNA、tRNA、rRNA测序服务)
m1A MAP-seq(云序生物提供m1A全转录组、mRNA、LncRNA、环状RNA、pri-miRNA、tRNA、rRNA单碱基测序服务)
m7G:
m7G MeRIP-seq(云序生物提供m7G全转录组、mRNA、LncRNA、环状RNA、pri-miRNA、tRNA测序服务)
O8G:
O8G IP-seq(云序生物提供O8G全转录组、mRNA、LncRNA、环状RNA、pri-miRNA测序服务)
ac4C:
acRIP-seq(云序生物提供ac4C 全转录组、mRNA、LncRNA、环状RNA、pri-miRNA、tRNA、rRNA测序服务)
2’-O甲基化:
Nm-seq(云序生物提供2’ O甲基化全转录组、mRNA、LncRNA、环状RNA、pri-miRNA、tRNA、rRNA单碱基测序服务)
假尿嘧啶Ψ:
BID-seq(云序生物提供假尿嘧啶RNA单碱基测序服务)
02检测整体RNA修饰水平
比色法检测整体RNA修饰水平
快速检测m6A整体甲基化水平
03 RNA修饰上游酶的筛选
RNA修饰相关酶PCR芯片
寻找上游直接调控m6A RNA甲基化的甲基转移酶。
04 RNA修饰靶基因验证
MeRIP-qPCR/GenSeq® MeRIP试剂盒
云序提供各类不同修饰的meRIP-qPCR服务,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。
05 机制互作研究
筛选或验证RNA修饰直接靶点,研究RNA修饰靶基因的调控机制。
筛选或验证目标RNA互作基因或蛋白,研究相应的分子调控机制。
筛选或验证目标蛋白与DNA互作,研究相应的分子调控机制。
06 翻译组
检测转录本上核糖体的分布和翻译活性,了解蛋白质表达情况以及翻译过程。
云序生物服务优势
优势一:云序累计支持客户发表 100+篇RNA修饰SCI论文,合计影响因子 1000+。
优势二:累计完成上万例 RNA甲基化测序样本,全面覆盖医口、农口等各类样本。
优势三:全面检测mRNA和各类非编码RNA(circRNA,lncRNA,Pri-miRNA等)。
优势六:国内较全的RNA修饰测序平台,提供m6A、m5C、m1A、m7G、m3C、O8G、ac4C乙酰化和2'-O-甲基化、假尿嘧啶测序,。
云序客户RNA修饰部分文章列表
相关产品
RNA修饰文章往期回顾