
轴突再生可以在解剖学上完整的脊髓损伤(SCI)中诱导,但强大的功能恢复是难以捉摸的。恢复神经功能是否需要将轴突从特定神经亚群定向再生到其自然目标区域尚不清楚。为了解决这个问题,瑞士联邦理工学院(EPFL)生命科学院NeuroX研究所的研究者们应用了投射特异性和单细胞核测序来识别在不完全SCI后恢复行走的神经细胞亚群。结果表明,化学吸引和引导这些神经元的横贯轴突到其自然目标区域导致小鼠在完全SCI后行走的实质性恢复。因此,重建关键神经元的自然投射是旨在恢复失去的神经功能的轴突再生策略的重要组成部分。研究成果以“Recovery of walking after paralysis by regenerating characterized neurons to their natural target region”为题,发表在Science(IF:56.9)上。

早在2018年,虽然研究团队亲眼见证了神经元的轴突从脊髓断裂面的一侧延伸到另一侧,两侧神经元成功建立了连接,甚至连神经电信号都部分恢复了,但遗憾的是,瘫痪小鼠的运动能力却没有丝毫改善。
于是,作者的研究团队卧薪尝胆5年,在Science新作中证明:关键神经元的筛选,可以逆转完全性截瘫。下面我们来欣赏一下这篇文献。
01表征参与自然恢复的神经元
腰椎脊髓中负责产生行走的神经亚群。通过对脊髓的单侧横切(Brown-Séquard综合症),这些神经元失去了来自大脑的重要上位神经输入,从而导致在受伤一侧无法产生行走。然而,无论是人类还是动物模型,在这些损伤之后都能够恢复双侧的行走能力。作者之前的研究表明,在这种情况下,位于胸椎脊髓的神经元通过绕过横切处的侧面,传递上位神经指令以恢复行走。即使是在时间和空间上分隔的、对立的一侧横切损伤中,中断了大脑到腰椎脊髓的所有直接投射的情况下,这些神经元仍然能够传递足够的上位神经输入,以恢复双侧行走。在胸椎脊髓中切除这些神经元并不会在没有损伤的情况下改变行走,但会消除在单侧或双侧横切损伤后观察到的自然恢复行走的现象。因此,这项研究的目的是解剖在这种自然恢复中起作用的神经亚群的分子和解剖学特性。
作者使用重组腺相关病毒2(rAAV2)注射具有增强绿色荧光蛋白(EGFP)核膜蛋白KASH的编码的病毒,将其注入未受伤的小鼠腰椎脊髓,以标记具有直接投射到腰椎脊髓的神经亚群。这种策略使得可以通过荧光激活的细胞核分选联合单核RNA测序(snRNA-seq)来获得与特定投射的神经亚群的转录组学特性。
snRNA-seq显示 EGFP-ON神经元主要位于胸椎神经元中的一个腹侧亚群(Hoxa7),这个亚群表达了标记Vsx2和长距离投射神经元的标记Zfhx3。作者将这些神经元命名为脊髓(SC)Vsx2::Hoxa7:Zfhx3→腰椎神经元。通过对未受伤的小鼠和康复行走的小鼠的神经核进行比较,发现SCVsx2::Hoxa7::Zfhx3→腰椎神经元在所有嵌套在康复行走小鼠胸椎部分的神经亚群中表现出最明显的转录反应。这证明了该群体参与自然恢复过程。
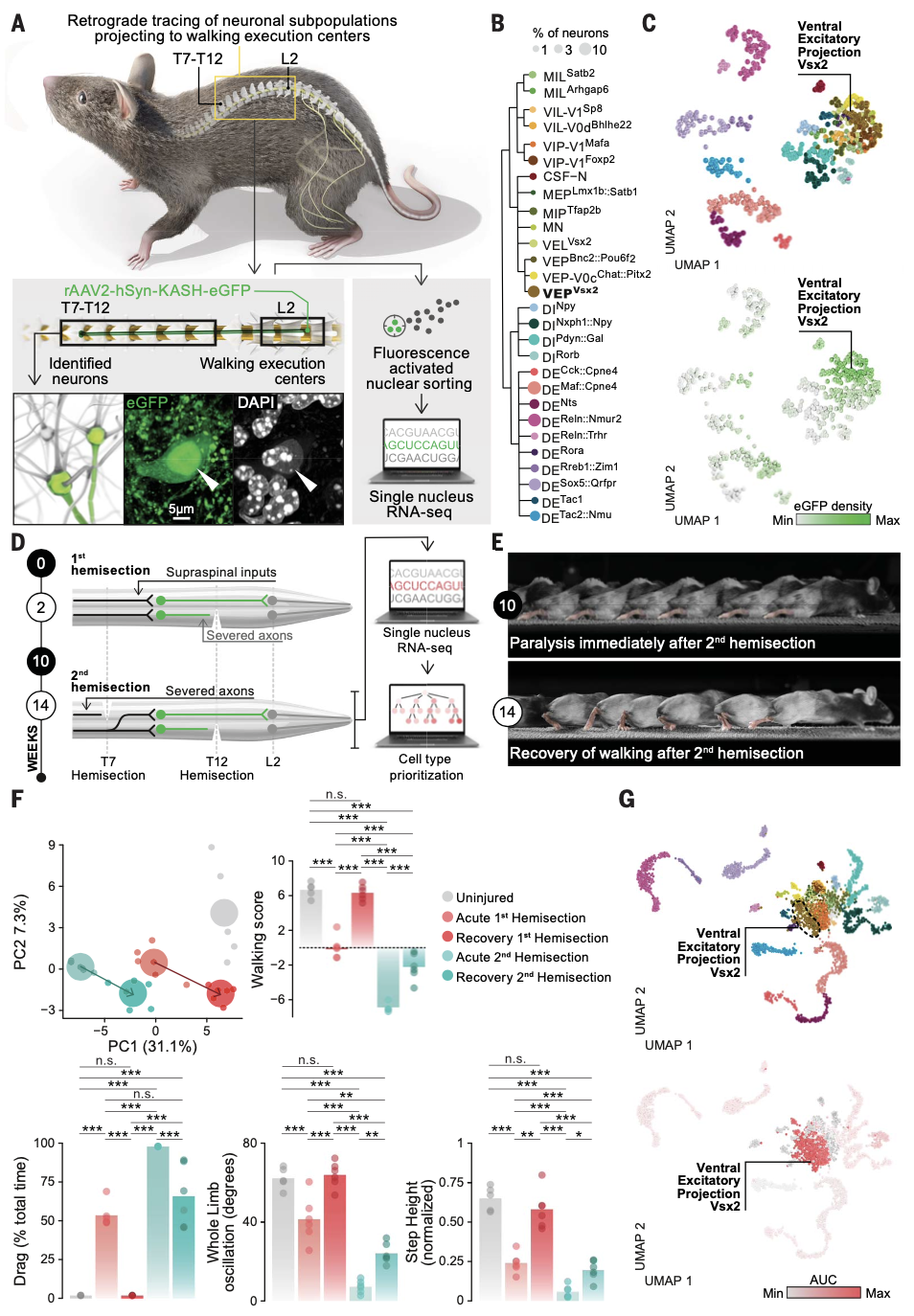
02胸部中继神经元的连接体特征
作者使用了交叉遗传学和在Vsx2-Cre小鼠中的病毒示踪来比较Vsx2-ON神经元的分布和连接组。研究发现,Vsx2-ON神经元占据中胸脊髓神经元的5.9%,对中胸脊髓Vsx2-ON神经元的示踪显示了其在整个腰椎脊髓的密集投射。研究者探究了中胸脊髓Vsx2ON神经元是否可以分成局部投射和长距离投射的亚群。在脊髓中,通过Zfhx3的表达可以区分具有局部和长距离投射的神经元。通过在Vsx2-Cre小鼠的腰椎脊髓注入rAAV2-Ef1a-DIO-Flpo,然后注入AAV5-Con/Fon-EYFP(增强的黄色荧光蛋白)到中胸脊髓,作者成功标记了只对腰椎脊髓进行投射的Vsx2-ON神经元。结果表明,Zfhx3和Vsx2仅在投射到这个区域的神经元中共定位(SCVsx2::Hoxa7::Zfhx3→lumbar)。对Vsx2-ON神经元的局部(Vsx2-ON,Zfhx3-OFF)与长距离投射(Vsx2-ON,Zfhx3-ON)的数量进行量化显示,这两个亚群在中胸脊髓神经元中分布近乎相等。
作者推断,作为上位神经命令的中继,SCVsx2::Hoxa7::Zfhx3→腰椎神经元还必须接收来自参与瘫痪后行走恢复的关键上位神经元的直接投射。为了揭示这个连接组,作者在巨细胞核中注入AAV5-CMV-TurboRFP(CMV,巨细胞病毒;RFP,红色荧光蛋白),因为巨细胞核神经元对于这种恢复至关重要,然后在腰椎脊髓注入rAAV2-hSyn-GFP,并标记Vsx2和vGlut2突触小体。结果显示,位于中胸脊髓的SCVsx2::Hoxa7::Zfhx3→lumbar神经元接收来自vGi的投射,并且在自然康复后这种投射模式得以保持。
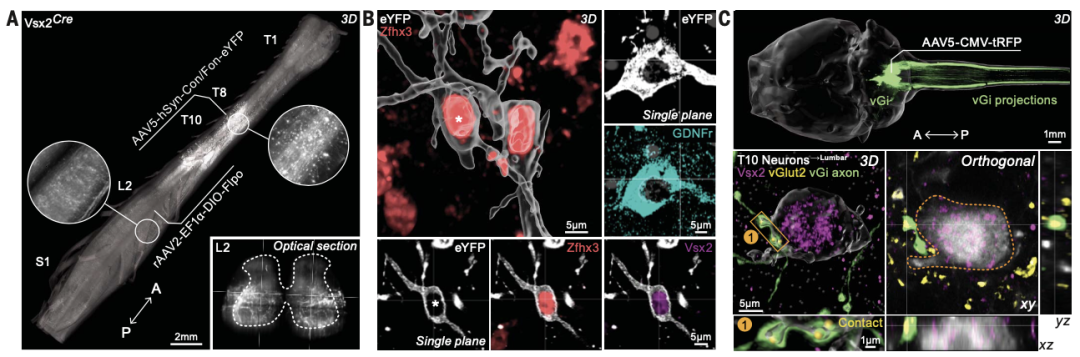
03 SCI后,轴突再生到其自然目标区域
通过用短距离或无定向再生填补损伤间隙不能简单地实现完全SCI后的行走恢复,而其中一个关键的附加要求之一必须是将轴突推动到它们在腰椎脊髓的自然目标区域。
研究者提出了这样的观点,即远距离轴突生长、成熟和突触形成的相对缓慢时间过程可能需要比生物材料沉积提供的更持续和更高浓度的化学引导生长因子传递。用慢病毒介导的GDNF表达替代生物材料沉积使轴突能够在远离的两个腰椎区域内进行广泛的再生,进一步证明了适当的化学引导梯度可以引导有向的远距离轴突再生,类似于发育过程中的方式。
为了确定再生的轴突是否包括源自SCVsx2::Hoxa7::Zfhx3→腰椎神经元的轴突,研究者将rAAV2-hSyn-KASH-EGFP注入到腰椎脊髓。这种策略在轴突已经再生到达腰椎脊髓的神经元中专门表达EGFP。位于损伤上方的EGFP-ON神经元被分选出进行snRNA-seq,所得的转录谱被整合到我们的胸椎脊髓的图谱中。将EGFP-ON神经元的分布与未受伤脊髓中神经亚群的分布进行比较,发现SCVsx2::Hoxa7::Zfhx3→腰椎神经元是主要受病毒标记的亚群,确认了这一神经亚群成功再生到其自然目标区域。追溯示踪结合Vsx2-ON和Chat-ON神经元的免疫标记证实了这些结果。
未受伤的小鼠表现出类似的投射模式,这表明再生的SCVsx2::Hoxa7::Zfhx3→腰神经元可能本质上改变与其自然目标的适当联系。我们还询问,在再生SCVsx2::Hoxa7::Zfhx3→腰神经元到达腰椎脊髓后,是否可以在解剖学上全SCI下方检测到脊柱上的命令。我们发现,vGi的微刺激在腿部肌肉中诱发了大运动诱发电位,揭示了脊髓上中心已经恢复了对腰椎脊髓的功能访问。这些结果表明,SCVsx2::Hoxa7::Zfhx3→腰神经元被设计为腰椎脊髓的自然目标区域再生功能性轴突。
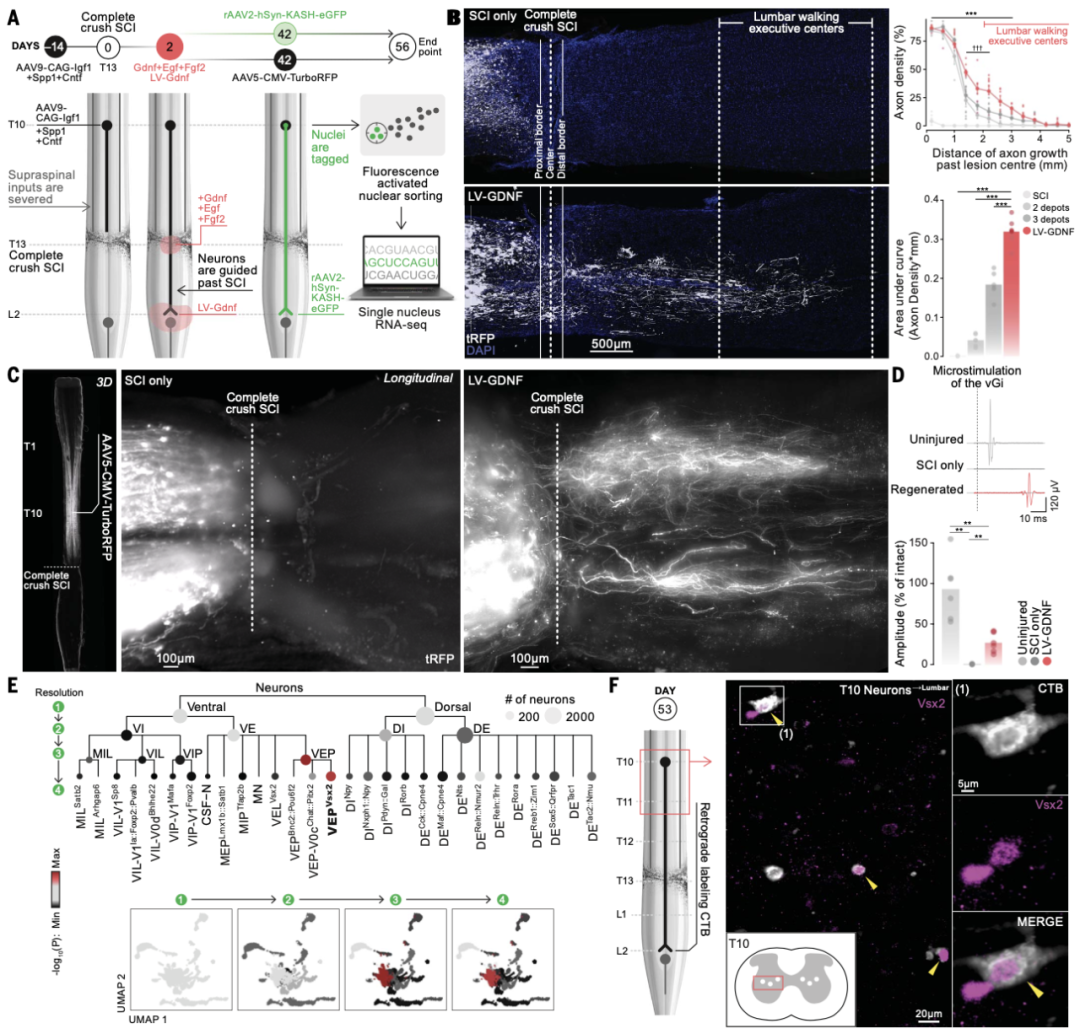
04 解剖学上完成 SCI 后行走的大幅恢复
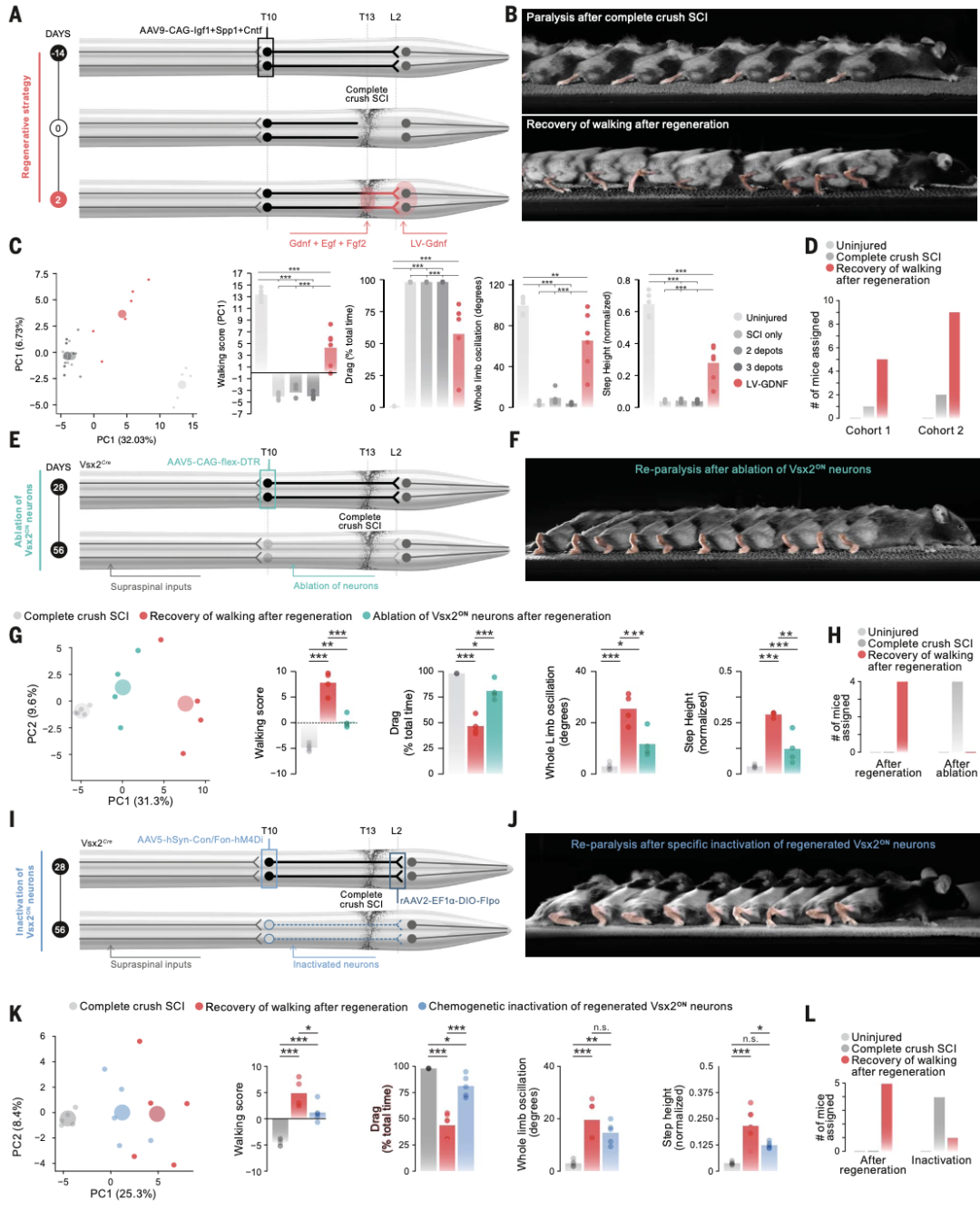
再生策略化学吸引并引导了参与自然恢复的分子定义的神经元亚群重新生长到腰椎脊髓的适当目标区域,我们预计这种策略可能会在完全瘫痪后恢复行走。因此,作者在行走期间对全身运动学进行了纵向量化。在所有小鼠中,再生策略促进了从SCVsx2::Hoxa7::Zfhx3→腰神经元到腰脊髓自然靶区的投影生长。这种再生与腿部运动的逐渐恢复相吻合,在脊髓损伤后约3至4周。最终评估在8周内进行。治疗组六只小鼠中有五只表现出类似于不完全 SCI 后小鼠量化的步态模式。这些结果表明,我们的再生策略导致了完全脊髓损伤后行走的实质性恢复。作者不能排除这些相对不丰富的神经元亚人群参与行走的恢复。因此,测试了SCVsx2::Hoxa7::Zfhx3→腰神经元的必要性,其再生投影到腰脊髓的适当目标区域,以恢复后行走,因为值得注意的是,它们参与了不完全 SCI后自然恢复。为此,我们首先通过在Vsx2-Cre小鼠的胸脊髓中表达白喉毒素接收(DTR)来消融这些神经元。SCI八周后,接受我们策略的所有小鼠都恢复了步态模式的行走能力,类似于在不完全SCI后恢复行走的小鼠的步态模式。激活白喉毒素后,解剖学分析证实了胸脊髓中Vsx2-ON神经元的几乎完全消融。这些重组确定了胸腔Vsx2-ON神经元在恢复后行走恢复中的作用。然而,他们没有确定局部与投射Vsx2-ON神经元各自的作用。作者在此测试了在完全 SCI 后行走恢复中从 SCVsx2::Hoxa7::Zfhx3→腰椎神经元到腰椎脊髓的项目的必要性。设计了一种交叉化学遗传策略,一旦小鼠表现出行走的实质性恢复,我们就可以使再生的SCVsx2::Hoxa7::Zfhx3→腰神经元静音。我们将rAAV2-Ef1a-DIO-Flpo注入第四组的腰脊髓,然后将AAV5-Con/Fon-hM4Di-mCherry注入胸椎。这些小鼠都展示了行走的预期恢复。氯氮-氧化物(CNO)的给药立即损害了所有测试小鼠的行走,导致步态模式类似于未经历再生的小鼠。相比之下,没有接受AAV5-Con/Fon-hM4Di-mCherry输注的小鼠没有受到CNO给药的影响。这些发现表明,从SCVsx2::Hoxa7::Zfhx3→腰神经元到腰脊髓的自然目标区域的再生投影有助于完全脊髓损伤后行走的实质性恢复。
总 结
这篇文章探讨了一种通过使特定的神经元再生到其自然目标区域来实现瘫痪后行走恢复的方法。研究的焦点是如何通过神经再生的方式,将受损的神经元重新连接到其原始的目标区域,从而促使瘫痪患者重新恢复行走功能。这项研究提供了有关神经再生对康复的潜在影响的见解,有望为治疗和康复瘫痪患者的方法提供新的理论和临床基础。
