元素杂质 elemental impurities
元素杂质有多种来源,合成工艺中金属催化剂的残留、原辅料的引入、生产设备和包装等接触材料带入等,均与药品质量研究密切相关。
国际人用药物注册技术协调会议(ICH)于2013年发布《Q3D元素杂质指导原则》,并进行多次修订,对元素杂质的分类、风险、每日允许暴露量(PDE)、限度和控制策略等进行了详细评估,旨在为药品中元素杂质的定性和定量控制提供指导方针。
本文将分享一些元素杂质检测项目抛砖引玉,与医药检测领域伙伴共同探索药物中的元素杂质研究。
案例分享 elemental impurities
Ⅰ.利用ICP-MS对某原料药中13种元素(铀U、钽Ta、铼Re、钍Th、铷Rh、铋Bi、铌Nb、铪Hf、镨Pr、铅Pb、镝Dy、铕Eu、铈Ce)进行了方法学开发与验证,系统适用性、专属性、灵敏度、线性、准确度、精密度、溶液稳定性等验证指标均符合可接受标准,检测结果中各元素杂质残留量均符合限度要求,帮助委托方完成该品种的元素杂质风险评估。

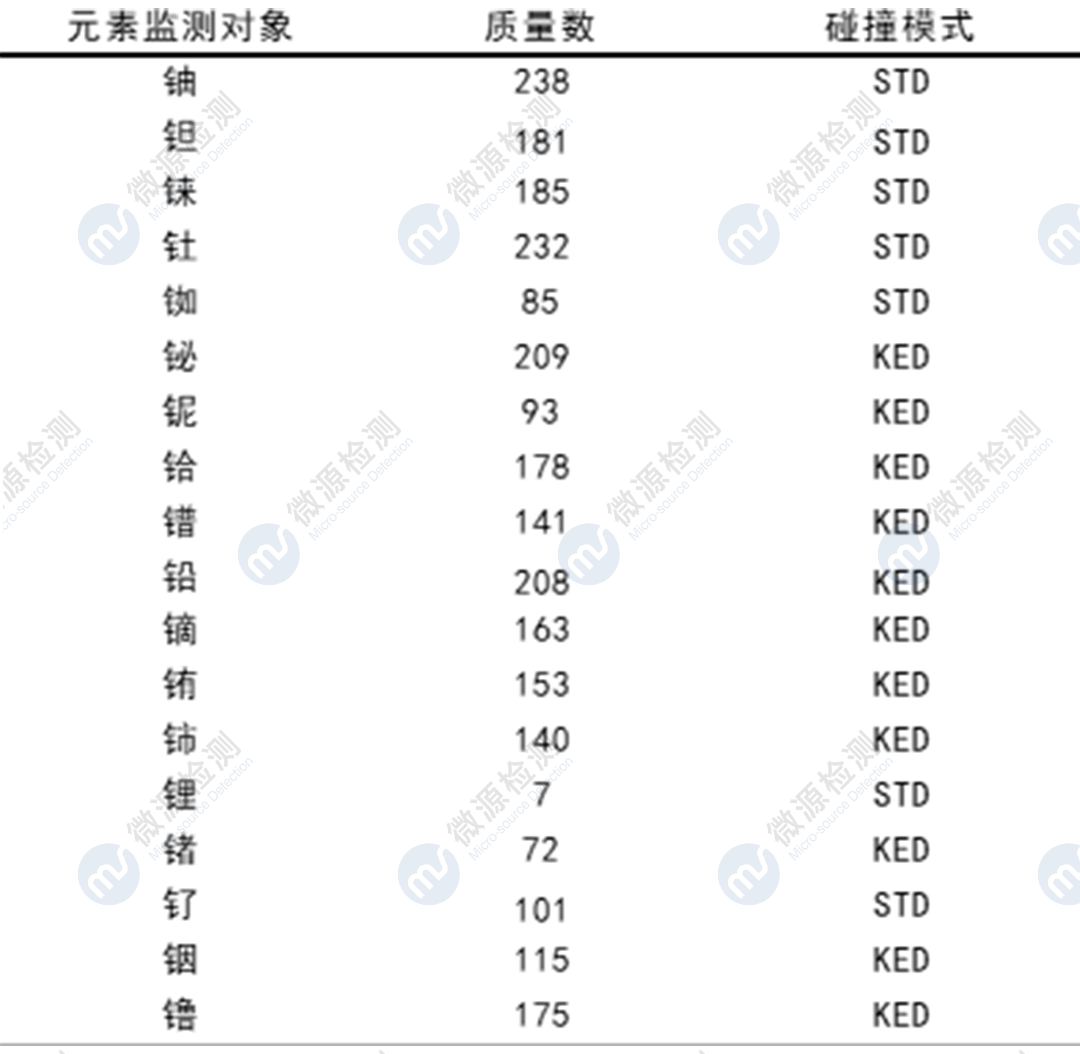

Ⅱ .利用ICP-OES对某原料药中2个元素(碘I、硅Si)进行了方法学开发与验证,系统适用性、专属性、灵敏度、线性、准确度、精密度、溶液稳定性等验证指标均符合可接受标准,检测结果中各元素杂质残留量均符合限度要求,帮助委托方完成该品种的元素杂质风险评估。

Ⅲ 利用ICP-MS对某创新药中7个元素(镉Cd、铅Pb、砷As、汞Hg、钴Co、钒V、镍Ni)进行了方法学开发与验证,系统适用性、专属性、灵敏度、线性、准确度、精密度、溶液稳定性等验证指标均符合可接受标准,检测结果中各元素杂质残留量均符合限度要求,帮助委托方完成该品种的元素杂质风险评估。

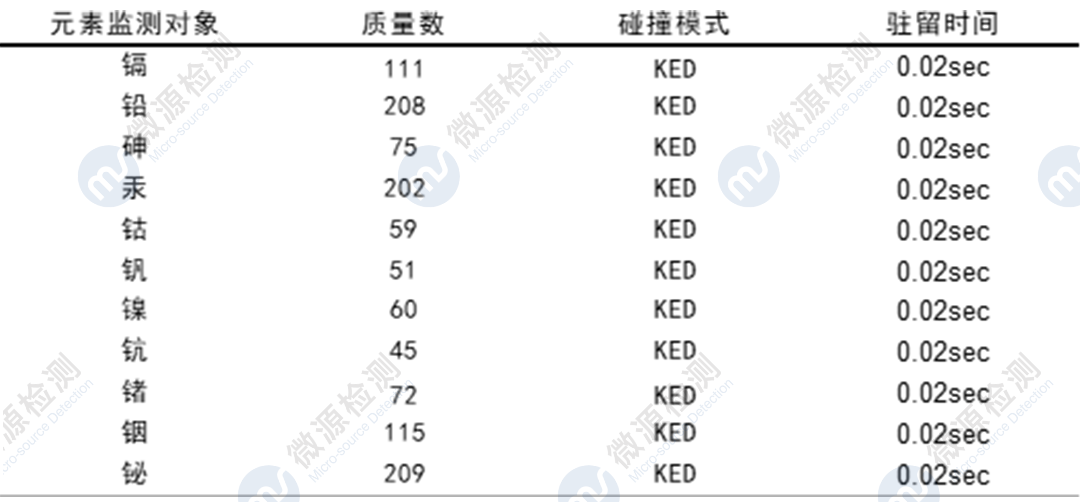

项目经验 elemental impurities
√ 口服药物中常规7种元素杂质检测、注射药物中常规10种元素杂质检测、吸入药物中常规14种元素杂质检测、质量工艺添加等其他高风险元素的检测;
√ 可根据不同测试需求,进行特殊限度的元素检测,满足低限度的方法学开发和方法学验证。根据客户需求及不同检测目的,满足境内外多体系药物注册申报研究要求并支持审计等……
指导原则 elemental impurities
⇲ ICH Q3D
⇲ USP <232>
⇲ USP <1225>
⇲ Ch.P四部指导原则
⇲ Ch.P四部通则0411
⇲ Ch.P四部通则0411
⇲ Ch.P四部通则2321
文末总结 elemental impurities
实验室根据各元素性质和限度进行方法开发(主要进行样品前处理的方法开发)和验证,提供快速高灵敏度的结果,确保数据结果的可靠性。代表批次检测并确定控制策略,已开发出65种元素的分析方法。
严格监测和控制元素杂质在药物制剂中的总量, 分析元素杂质可能引入的途径来制定控制策略, 如调整相关生产工艺、 选择合适的容器设备等, 以确保元素杂质水平控制符合限度要求, 为药品质量监管提供有力保障,微源检测元素杂质检测服务能够满足境内外多体系药物注册申报研究要求,支持客户审计,配合完成全球各国家或地区药监部门的现场核查。
