
病毒性疾病已成为影响人类健康的重大威胁之一,其中Ⅰ类包膜病毒引起的疾病传播甚广,危害极大,有些至今依然没有有效的疫苗或抗病毒药物获批上市。Ⅰ类包膜病毒表面融合糖蛋白(F蛋白)在病毒入侵宿主细胞中起着至关重要的作用,在病毒进入宿主细胞时,为了介导病毒膜与宿主细胞膜的融合,其构象由不稳定的膜融合前状态(Pre-F)转变为稳定的膜融合后(Post-F)状态。F蛋白作为感染过程中的关键角色,已成为抗病毒药物和疫苗研发的重要靶点。
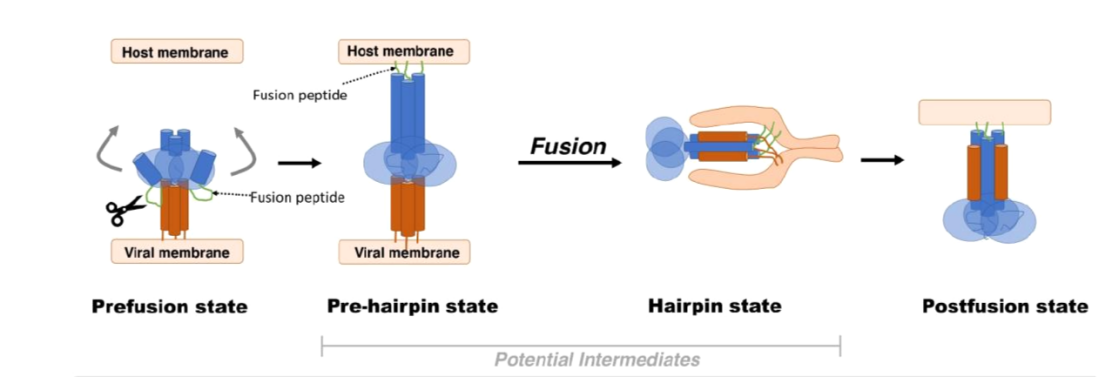
膜融合模型
呼吸道合胞病毒(Respiratory Syncytial Virus,RSV)作为Ⅰ类包膜病毒的代表,其研发历程几经坎坷,浮浮沉沉60余年,终于在今年5月迎来了胜利的号角。
为什么RSV疫苗研发如此之难? 这与它的特殊结构有关,RSV是一种单链RNA病毒,包括8种结构蛋白(F、G、M2-1、M2-2、SH、N、P、L)和 3 种非结构蛋白(NS1、NS2、NS3)。其中融合蛋白(F蛋白)和粘附蛋白(G蛋白)是病毒入侵人体的关键,二者都可以成为疫苗研发的理想靶点,而由于G蛋白变异较多相对不稳定,F蛋白便成为了重要靶点。但是,F蛋白有两种构象:高度稳定的融合后(Post-F)构象和不稳定的融合前(Pre-F)构象。

起初的疫苗更多采用稳定的Post-F构象,但因其免疫原性不强没能取得理想的效果。转折发生在2013年,美国国家过敏症和传染病研究所的Barney Graham及其同事取得了一项重大科学突破,研究出如何将RSV F蛋白锁定在其预融合(Pre-F)状态,并证明Pre-F相比post-F能引发更高水平的强效抗体。

今年获FDA批准上市的GSK的Arexvy和Pfizer的 Abrysvo这两款RSV疫苗均是获益于此科学突破开发出的基于Pre-F构象的强效疫苗,可用于预防60岁及以上老年人因呼吸道合胞病毒(RSV)引起的下呼吸道疾病(LRTD)。
Pre-F构象的概念正被成功地应用于相近的病毒,包括尼帕病毒、亨德拉病毒等。基于结构的抗原设计可以为一个家族的病原体提供一体的解决方案。在新冠的后疫情时代,依然有如流感病毒、狂犬病毒、呼吸道合胞病毒、人乳头瘤病毒等多种传染性病毒在不断威胁着我们的生命安全。为阻断病毒的传播,ACROBiosystems一直致力于加速传染病疫苗及抗病毒药物的研发上市进程。基于这个理念,ViruStop品牌应运而生。
ViruStop基于专业的结构导向的天然构象蛋白设计开发平台、抗体开发平台和应用分析平台,已成功开发出全套适用于传染病疫苗及抗病毒药物研发的核心工具,包含经验证具有天然构象的病毒抗原蛋白、广谱及构象特异性抗体、抗原及抗体滴度检测试剂盒等产品,覆盖RSV、NiV、HeV、HIV、Influenza、VZV、Coronavirus等多种流行病毒。除此之外,还可提供基于假病毒平台的抗病毒药物的筛选和评价、中和抗体检测以及疫苗效价评估服务。
| RSV | NiV | HeV | HIV |
| Influenza | VZV | Coronavirus | …… |
HRSV Pre-F天然三聚体构象蛋白验证数据
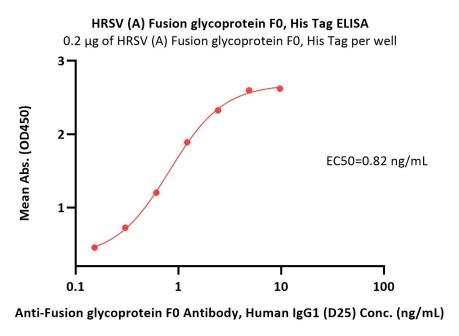
经ELISA验证,Pre-F三聚体蛋白与Pre-F特异性抗体(D25)结合线性范围为0.2-1 ng/mL
注:另有生物素及FITC标记的Pre-F天然三聚体构象蛋白、G蛋白供您选择。
HRSV Post-F天然三聚体构象蛋白验证数据
经ELISA验证,Post-F三聚体蛋白可以与RSV-F广谱抗体101F结合
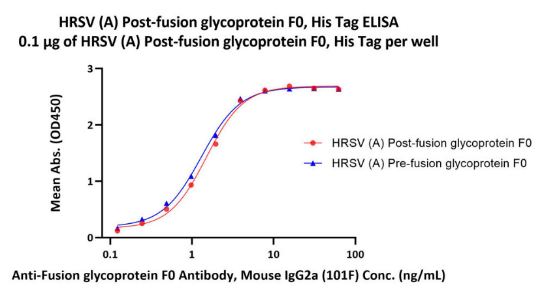
经ELISA验证,Post-F三聚体蛋白与Pre-F构象特异性抗体D25无结合
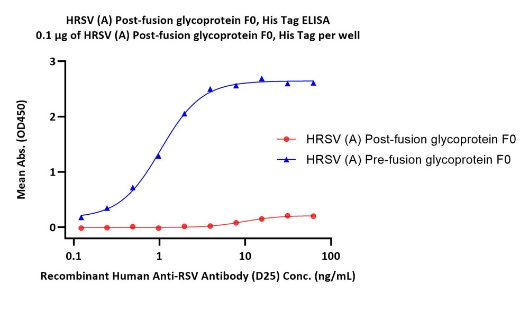
Immobilized Pre-F (Cat. No. RSF-V52H7) can bind Recombinant Human Anti-RSV Antibody (D25) with a linear range of 0.1-2 ng/mL. Post-F (Cat. No. RSF-V52H6) is verified not recoginized by D25.
注:经验证Post-F天然三聚体构象可以与RSV-F广谱抗体101F、131-2A结合,与Pre-F构象特异性抗体D25,AM14,5C4不结合。
经ELISA验证,Pre-F特异性抗体12C6可特异性识别Pre-F三聚体,与Post-F三聚体不结合
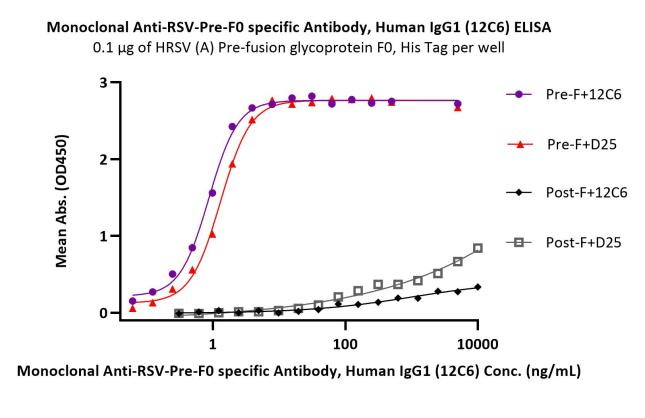
Immobilized HRSV (A) Pre-F, His Tag(Cat. No. RSF-V52H7) at 1 μg/mL can bind Monoclonal Anti-RSV-Pre-F0 specific Antibody(12C6) (Cat. No. RS0-S286)/Anti-Fusion glycoprotein F0 Antibody (D25) with a linear range of 0.1-2 ng/mL. HRSV (A) Post-F0 (Cat. No.RSF-V52H6) is verified not recoginized by Monoclonal Anti-RSV-Pre-F0 specific Antibody (12C6)(Cat. No. RS0-S286)/Anti-Fusion glycoprotein F0 Antibody(D25) in low concentration.
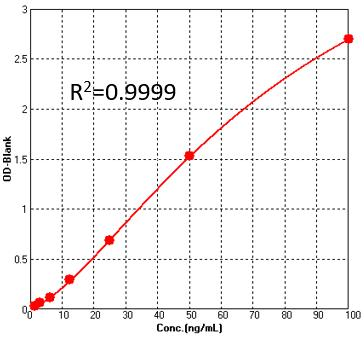
经验证检测灵敏度可达3.1 ng/mL
|
病毒类型 |
产品描述 |
货号 |
|
RSV |
Trimeric Pre-F protein |
|
|
Trimeric Post-F protein |
||
|
Pre-F specific antibody (Clone: 12C6) |
||
|
Pre-F specific ELISA kit |
||
|
Nipah |
Trimeric Pre-F protein |
|
|
Trimeric Post-F protein |
||
|
Hendra |
Trimeric Pre-F protein |
|
|
VZV |
Glycoprotein E protein |
|
|
Glycoprotein E ELISA kit |
||
|
HIV |
GP41 Pre-hairpin intermediate protein |
|
|
Influenza |
Influenza A [A/Darwin/9/2021 (H3N2)] Hemagglutinin (HA) Trimer protein |
|
|
Influenza A [Sydney/5/2021 (H1N1)] Hemagglutinin (HA) Trimer protein |
||
|
Coronavirus |
SARS-CoV-2 Spike Trimer protein (XBB.1.5/Omicron) |
参考文献
● Narkhede YB, et al. Targeting Viral Surface Proteins through Structure-Based Design. Viruses. 2021 Jul 8;13(7):1320. doi: 10.3390/v13071320.
● McLellan JS, et al. Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus. Science. 2013 Nov 1;342(6158):592-8. doi: 10.1126/science.1243283.
● Graham BS, Gilman MSA, McLellan JS. Structure-Based Vaccine Antigen Design. Annu Rev Med. 2019 Jan 27;70:91-104. doi: 10.1146/annurev-med-121217-094234.

ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)


